
科目: 来源: 题型:选择题
| A. | 干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同 | |
| B. | 白磷(P4)分子是正四面体结构,故分子中的键角为1090281 | |
| C. | CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相等 | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目: 来源: 题型:解答题
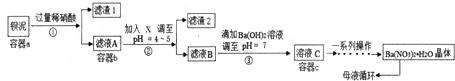
查看答案和解析>>
科目: 来源: 题型:解答题
 水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题:
水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
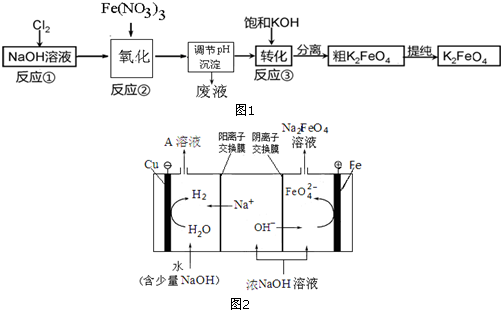
查看答案和解析>>
科目: 来源: 题型:解答题
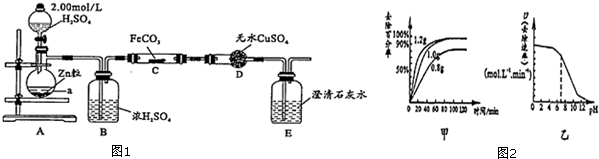
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C15H31COOH和C17H35COOH是同系物 | |
| B. | 结构不同,性质相同,化学式相同的物质互称同分异构体 | |
| C. | 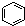 和 和 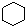 均是芳香烃, 均是芳香烃,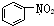 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| D. | 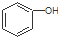 和 和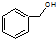 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中未成对电子最多的元素 |
| G的3d能级只含有2对成对电子 |
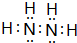 .
. 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com