
科目: 来源: 题型:选择题
| A. | 两者的质量数不同 | B. | 两者的中子数不同 | ||
| C. | 两者的核外电子数相同 | D. | 两者互为同素异形体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 816O、817O、818O互为同素异形体 | |
| B. | 正戊烷、异戊烷、新戊烷互为同系物 | |
| C. | O2与O3互为同位素 | |
| D. | CH3-CH2-OH与CH3-O-CH3互为同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子半径:S2->Cl->Ca2+ | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe、Cu、Zn原子最外层电子数依次增多 | |
| B. | N、O、F元素最高正化合价依次升高 | |
| C. | P、S、Cl第一电离能依次增大 | |
| D. | Na、K、Rb的金属性依次增强 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
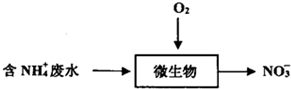
| A. | 生物硝化法处理废水,会导致水体pH逐渐下降:NH4++202=NO3-+2H++H20 | |
| B. | 长期过量使用NH4Cl等铵态化肥,易导致土壤酸化,水体富营养化 | |
| C. | 检验NH4+所需的试剂是浓NaOH溶液,湿润的蓝色石蕊试纸 | |
| D. | 微生物保持活性的pH范围为7〜9,可以加入石灰石来调节水体的pH |
查看答案和解析>>
科目: 来源: 题型:实验题
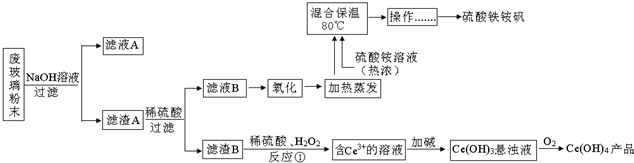

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com