
科目: 来源: 题型:推断题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子浓度大小关系为c(Na+)>c(Cl-)>c(HS-)>c(H+)>c(OH-) | |
| B. | c(Na+)+c(H+)=c(Cl-)+c(HS-)+c(OH-) | |
| C. | c(HS-)+c(H2S)=0.04 mol/L | |
| D. | c(H+)-c(OH-)=0.02-c(H2S)+c(S2-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子反应中一定有沉淀生成 | |
| B. | 反应中有气体生成的反应一定是离子反应 | |
| C. | 复分解型离子反应是一定有沉淀、气体和水生成的反应 | |
| D. | Fe2O3与稀硫酸的反应一定属于离子反应 |
查看答案和解析>>
科目: 来源: 题型:推断题
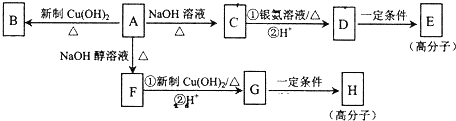
 .
. ,E的结构简式是
,E的结构简式是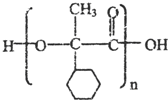 .
.查看答案和解析>>
科目: 来源: 题型:推断题
 .MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑.
.MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目: 来源: 题型:推断题
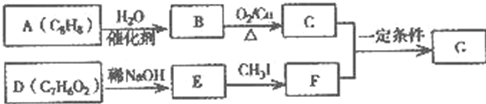

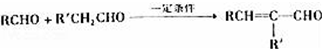
 .
. .
.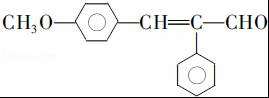 .
.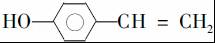 (写结构简式).
(写结构简式).查看答案和解析>>
科目: 来源: 题型:推断题
 .
.查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
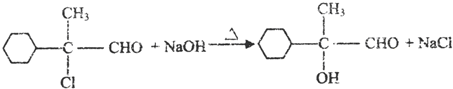
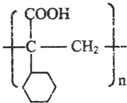
科目: 来源: 题型:推断题
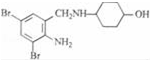 ,不考虑立体异构)是临床上使用广泛的药物.如图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的药物.如图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)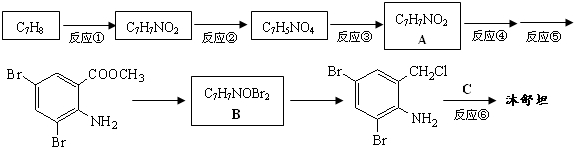
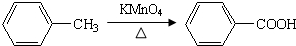 ,完成下列填空:
,完成下列填空: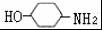 +2
+2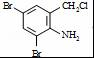 +K2CO3→2
+K2CO3→2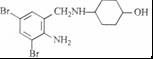 +2KCl+CO2↑+H2O.
+2KCl+CO2↑+H2O.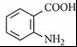 B
B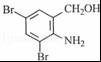 .
.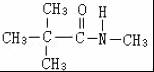 、
、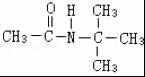 .
.查看答案和解析>>
科目: 来源: 题型:实验题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com