
科目: 来源: 题型:填空题
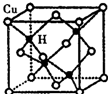 科学研究表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)
科学研究表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO) .
.查看答案和解析>>
科目: 来源: 题型:推断题
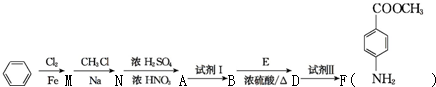
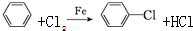
 苯胺(弱碱性,易氧化)
苯胺(弱碱性,易氧化)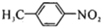 .
.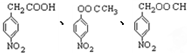 任意2种.
任意2种.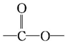 结构.
结构.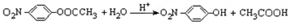 .
.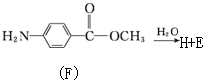 化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域.请写出该缩聚反应的化学方程式
化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域.请写出该缩聚反应的化学方程式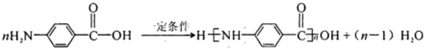 .
.查看答案和解析>>
科目: 来源: 题型:推断题
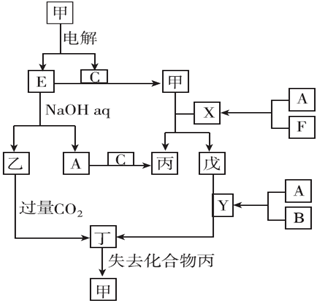
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验 | 实验现象 | 结 论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Cu>Fe |
B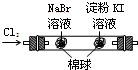 | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 白色固体先变为淡黄色,后变为黑色(Ag2S) | 溶解性:AgCl>AgBr>Ag2S |
D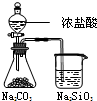 | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 酸性:HCl>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:推断题
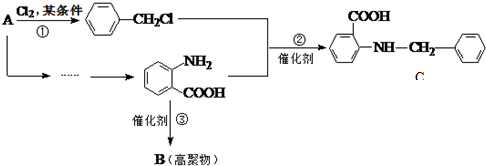
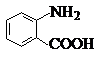 中官能团的名称氨基、羧基.
中官能团的名称氨基、羧基.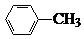 +Cl2$\stackrel{光}{→}$
+Cl2$\stackrel{光}{→}$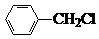 +HCl.
+HCl.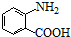 多一个碳的同系物,则满足下列条件的D的同分异构体共有19种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式
多一个碳的同系物,则满足下列条件的D的同分异构体共有19种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式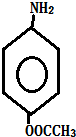 等.
等. .
.查看答案和解析>>
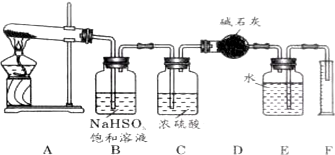
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:推断题
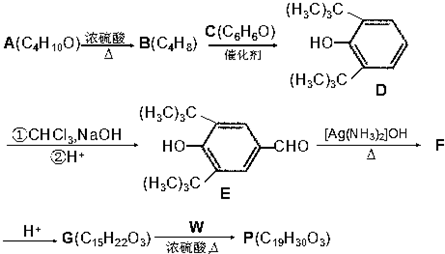
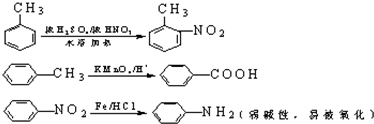
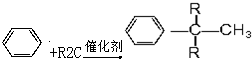 (R为烷基)
(R为烷基)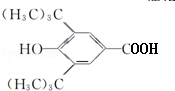 ;E中含有的官能团名称是羟基和醛基;
;E中含有的官能团名称是羟基和醛基;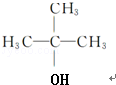 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;该反应类型为消去反应;
+H2O;该反应类型为消去反应;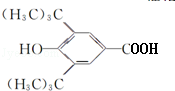 +CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$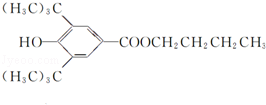 +H2O;该反应类型为酯化反应;
+H2O;该反应类型为酯化反应;查看答案和解析>>
科目: 来源: 题型:推断题
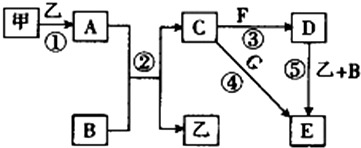
查看答案和解析>>
科目: 来源: 题型:实验题
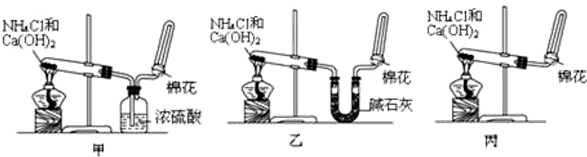
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com