
科目: 来源: 题型:解答题
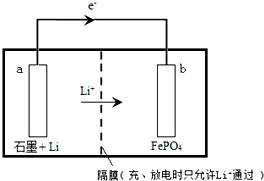 LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备.
LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备.查看答案和解析>>
科目: 来源: 题型:解答题
| 实验装置 | 现象 |
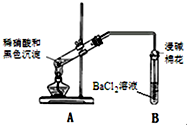 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:解答题
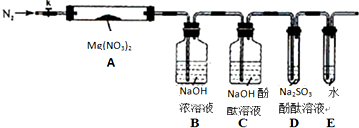
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Ca(ClO)2溶液中通入少量SO2Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO | |
| B. | 1mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2═2Fe3++4Br2+10Cl- | |
| D. | 向NH4HCO3溶液中加入足量NaAlO2溶液:NH4++2AlO2-+HCO3--+2H2O═NH3↑+2Al(OH)3↓+CO32-. |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 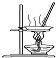 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. |  图装置可用于收集H2、NH3、NO等气体 | |
| C. | 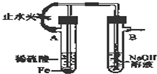 图装置能较长时间观察到Fe(OH)2白色沉淀 | |
| D. |  图能比较MnO2、Cl2、I2的氧化性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业采用火法炼铜:Cu2S+O2=2Cu+SO2 每生成2mol铜,反应共转移4NA个电子 | |
| B. | 7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.1NA | |
| C. | CO2通过Na2O2使其增重bg时,反应中转移的电子数为$\frac{b{N}_{A}}{44}$ | |
| D. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数目为0.02NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| B. | 含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 | |
| C. | 石油裂解、煤的气化、海水制镁都包含化学变化 | |
| D. | 工业上为了加快分离胶体中的电解质杂质,常在渗析袋外施加电场,使电解质离子透过半透膜向两极移动,该操作是应用胶体的电泳原理 |
查看答案和解析>>
科目: 来源: 题型:选择题
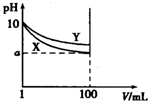 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | X、Y两种碱溶液中溶质的物质的量浓度一定相等 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性强 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸 的体积Vx>Vy | |
| D. | 若8<a<10,则X、Y都是弱碱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 | |
| B. | 乙烯能使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同 | |
| C. | Mg(OH)2难溶于水,但可缓慢溶于浓的NH4Cl溶液 | |
| D. | 油脂在酸性条件下可以水解,可用此反应可以制作肥皂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO- | |
| C. | 该消毒液与洁厕灵(成分为HCl)混用,产生Cl2:2H++Cl-+ClO-=Cl2↑+H2O | |
| D. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com