
科目: 来源: 题型:选择题
| A. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3 NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
查看答案和解析>>
科目: 来源: 题型:实验题
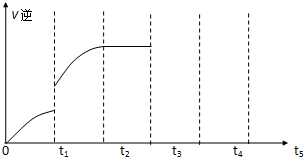
查看答案和解析>>
科目: 来源: 题型:实验题
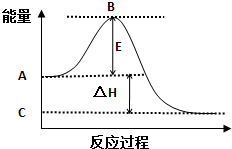 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入少量W,逆反应速率增大 | |
| B. | 通入一定量氦气,压强增大,平衡向正反应方向移动 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 降低温度,正反应速率减小,逆反应速率也减小,平衡向逆反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 存在电离只有HCO3-?H++CO32-,H2O?H++OH- | |
| B. | HCO3-的电离程度大于HCO3-的水解程度 | |
| C. | c (Na+)+c (H+)═c (HCO3-)+c (CO32-)+c (OH-) | |
| D. | c (Na+)═c (HCO3-)+c (CO32-)+c (H2CO3) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH- | |
| B. | 常温下,NaHCO3溶液显碱性:HCO3-+H2O?CO32-+H3O+ | |
| C. | 氢氧化镁与稀硫酸反应:H++OH-═H2O | |
| D. | 硫酸亚铁酸性溶液中加入过氧化氢:Fe2++H2O2+2H+═Fe3++2H2O |
查看答案和解析>>
科目: 来源: 题型:推断题
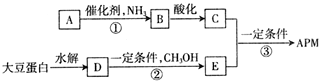
 .C中所含官能团的名称为羧基、氨基.
.C中所含官能团的名称为羧基、氨基. .
.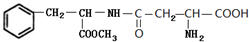 和
和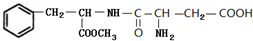 .
.查看答案和解析>>
科目: 来源: 题型:实验题
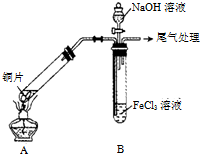 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).查看答案和解析>>
科目: 来源: 题型:推断题
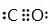 ,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.
,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向10mL 0.1mol•L-1的NaHCO3溶液中滴加3mL0.2mol.L-1盐酸后所得溶液中:c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合所得酸性溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中c(CH3COO-)+c(H+)<c(Na+)+c(OH-) | |
| D. | 0.1 mol•L-1( NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com