
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:选择题
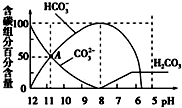
| A. | 0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 当加入20 mL盐酸时,混合溶液的pH约为8 | |
| C. | 常温下CO2饱和溶液的pH约为5.6 | |
| D. | 在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向烧碱溶液中通入少量二氧化碳:2OH-+CO2═CO32-+H2O | |
| B. | 向明矾溶液中滴加过量氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向纯碱溶液中加入少量醋酸:CO32-+H+═HCO3- | |
| D. | 向小苏打溶液中加入少量石灰水:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通过测定沸点区别生物柴油和矿物柴油 | |
| B. | 用水区别乙酸、溴苯和硝基苯 | |
| C. | 用溴水区别环己烷、甲苯和环己烯 | |
| D. | 用燃烧法区别乙醇、苯和四氯化碳 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纳米碳管是一种无机化合物 | |
| B. | 0.12g纳米碳管中含有6.02×l022个碳原子 | |
| C. | 纳米碳管与石墨互为同位素 | |
| D. | 纳米碳管中碳原子间以共价键结合 |
查看答案和解析>>
科目: 来源: 题型:实验题
 利用如图所示的装置和其他必要的仪器用品,完成下列实验.
利用如图所示的装置和其他必要的仪器用品,完成下列实验.查看答案和解析>>
科目: 来源: 题型:选择题
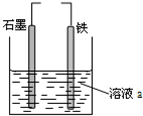
| A. | 若两电极直接连接,a是食盐水,则发生析氢腐蚀 | |
| B. | 若铁接电源负极,石墨接电源正极,a是稀H2SO4溶液,电解一段时间后溶液的pH增大 | |
| C. | 若两电极直接连接,则电子从铁流向石墨 | |
| D. | 若铁接电源正极,石墨接电源负极,a是氯化铜溶液,阴离子向石墨电极移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X可用新制的氢氧化铜检验 | B. | Y有同分异构体 | ||
| C. | M含有两种碳氧共价键 | D. | Y可发生加成反应 |
查看答案和解析>>
科目: 来源: 题型:推断题
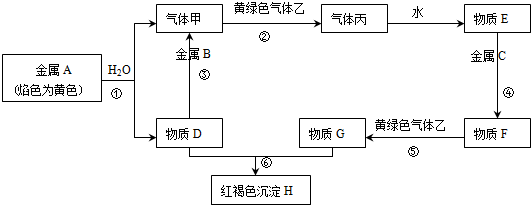
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com