
科目: 来源: 题型:解答题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目: 来源: 题型:解答题
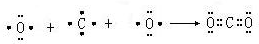
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
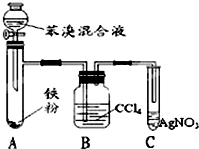 如表是A、B、C三种烃的有关信息;
如表是A、B、C三种烃的有关信息;| A | B | C |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  | 1棍模型为: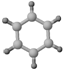 ②平面型结构 | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与H2在一定条件下反应生成A |
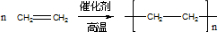 .
. .
. .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)小 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 | |
| C. | 25℃时,在等体积等浓度的氨水、NH4Cl溶液中,Mg(OH)2的Ksp前者小于后者 | |
| D. | 25℃时,在MgF2的悬浊液中通入少量的HF气体,c(Mg2+)减小 |
查看答案和解析>>
科目: 来源: 题型:实验题
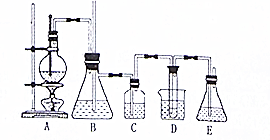 实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:
实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:| 常温下颜色状态 | 密度 | 熔点 | 沸点 | 溶解性 |
| 无色液体 | 2.18g/cm3 | 9.79℃ | 131.4℃ | 不溶于水、一溶于醇、醚、丙酮 |
查看答案和解析>>
科目: 来源: 题型:解答题
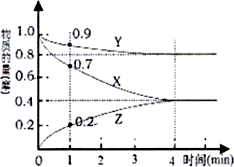 (1)某温度时,在2L的密闭容器在X、Y、Z三种物质的量随时间的变化如图所示.
(1)某温度时,在2L的密闭容器在X、Y、Z三种物质的量随时间的变化如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
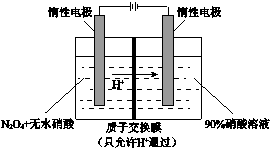 氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义.
氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义.查看答案和解析>>
科目: 来源: 题型:解答题
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |

查看答案和解析>>
科目: 来源: 题型:多选题
| A. | CH4和C3H8 | B. | CH4和C3H4 | C. | C2H4和C2H6 | D. | C2H2和C2H6 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com