
科目: 来源: 题型:选择题
 已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1×10-12.如图是向10mLAgNO3溶液中逐滴加入0.1mol•L-1NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1×10-12.如图是向10mLAgNO3溶液中逐滴加入0.1mol•L-1NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 原AgNO3溶液的物质的量浓度为0.1 mol•L-1 | |
| B. | 图中x点的坐标为(10,6) | |
| C. | 图中x点表示溶液中c(Ag+)=c(Cl-) | |
| D. | 把0.1 mol•L-1的NaCl溶液换成0.1 mol•L-1的NaI溶液,则图象在终点后变为虚线部分 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 尽管NO2能与水反应生成硝酸,但NO2不属于酸性氧化物 | |
| B. | Na2O2粉末加入到FeSO4溶液中,产生白色沉淀,并放出大量气泡 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 往酸性KMnO4溶液中通入SO2验证SO2的漂白性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用 | |
| B. | KNO3、KClO3与单质S、C2H5OH混搭存放在同一库房间 | |
| C. | 包装用材料聚乙烯、聚氯乙烯等都属于烃 | |
| D. | 绿色化学的核心就是治理工业生产对环境产生的污染 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将混合气体通过氢氧化钠溶液 | |
| B. | 使混合气体中的乙烯发生加聚反应 | |
| C. | 将混合气体在催化剂条件下跟氢气反应 | |
| D. | 将混合气体通过溴水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 标准状况下,1 molCH2Cl2所占有的体积约为22.4L | |
| C. | 常温常压下,38g 18OH-中含质子数20NA | |
| D. | 14g C2H4和C3H6的混合气体含有的原子总数为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②>①>④>③ | B. | ①=②=③=④ | C. | ②=③>①=④ | D. | ②<①<③<④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,11.2L的乙烷所含的分子数为0.5NA | |
| B. | 0.5mol C3H8分子中含C-H共价键4NA | |
| C. | 11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
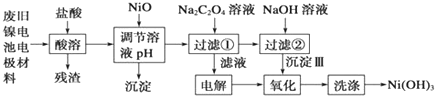
查看答案和解析>>
科目: 来源: 题型:解答题
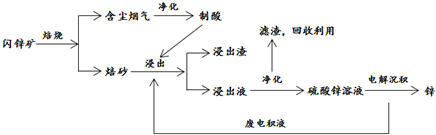
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com