
科目: 来源: 题型:选择题
| A. | 全部可以 | B. | 仅②可以 | C. | 仅②⑤可以 | D. | ①③④可以 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 75.3g | B. | 2.2mol | C. | 1.2mol | D. | 1mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| B. | 分别加水稀释10倍,四种溶液的pH ①>②>④>③ | |
| C. | VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va:Vb=9:11 | |
| D. | ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
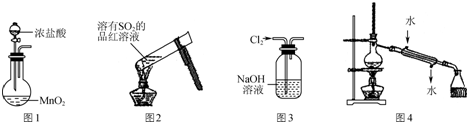
| A. | 实验室用图1装置制备Cl2 | |
| B. | 加热后图2中溶液颜色恢复红色 | |
| C. | 用图3装置除去Cl2中含有的少量HCl | |
| D. | 实验室用图4装置制取少量蒸馏水 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C、N、O的原子半径依次减小 | |
| B. | Si、P、S元素的最高正价依次降低 | |
| C. | Na、Mg、Al原子的最外层电子数依次减少 | |
| D. | Li、Na、K的金属性依次减弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol OD-离子含有的质子、中子数均为10NA | |
| B. | 标准状况下,4.48 L己烷含有的分子数为0.2NA | |
| C. | 标准状况下,6.72LNO2与水反应消耗的氧化剂分子数为0.2NA | |
| D. | 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K+、Na+、HCO3-、Cl- | B. | K+、AlO2-、Br-、Cl- | ||
| C. | Na+、Cl-、NO3-、I- | D. | Al3+、NH4+、Cl-、SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素代号 | 部分特征 |
| A | 气态单质在标准状况下密度是0.0893g/L |
| B | 形成的化合物的种类最多 |
| C | 形成的氧化物的种类最多 |
| D | 形成的化合物焰色反应呈黄色 |
| E | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
| F | 最高价氧化物对应的水化物酸性在短周期中最强 |
 ,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.
,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com