
科目: 来源: 题型:选择题
| A. | CS2的电子式为: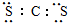 | B. | Ca2+的离子结构示意图为: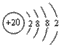 | ||
| C. | HClO的结构式为:H-O-Cl | D. | 氯化铵的电子式为: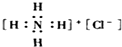 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 14C的质量数为14g•mol-1 | B. | 14C与12C是两种不同的核素 | ||
| C. | 14C与C60互为同素异形体 | D. | 14C与14N的中子数相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
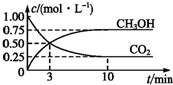 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3 119.6 kJ•mol-1 | |
| B. | C2H6(g)+$\frac{5}{2}$O2(g)═2CO(g)+3H2O(g)△H=-1 559.8 kJ•mol-1 | |
| C. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(g)△H=-1 559.8 kJ•mol-1 | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1 559.8 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
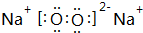 ,用电子式表示该化合物的形成过程
,用电子式表示该化合物的形成过程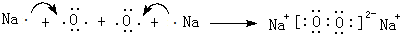 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第ⅠA族 | B. | 第ⅣA族 | C. | 第ⅠA族或第ⅠB族 | D. | 第ⅢA族或第ⅢB族 |
查看答案和解析>>
科目: 来源: 题型:解答题

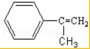 ;
;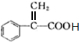 ;
;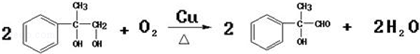 ;
;查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 其含有的共价键类型是极性共价键.
其含有的共价键类型是极性共价键.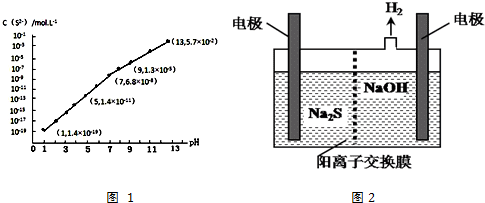
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com