
科目: 来源: 题型:选择题
| A. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| B. | 检验某卤代烃中是否含溴:加入NaOH溶液,加热,冷却,再加入硝酸银溶液 | |
| C. | 苯不能与溴水发生取代反应,用苯能萃取溴的四氯化碳溶液中的溴 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
查看答案和解析>>
科目: 来源: 题型:解答题
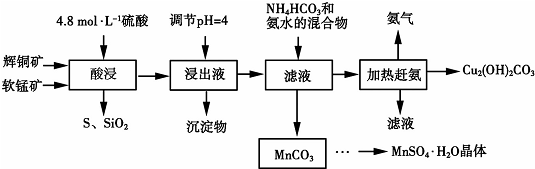
| 物质 | Cu(OH)2 | Fe(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 8.3 | 1.4 |
| 沉淀完全pH | 13 | 14 | 9.8 | 3.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
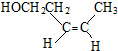 、(反式)
、(反式)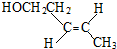 .若该单烯烃继续发生消去反应,生成的产物与溴单质按1:1的比例加成,得到的所有产物的结构简式(不考虑立体异构)为:CH2BrCHBrCH=CHCH3、CH2=CH-CHBrCHBrCH3、CH2Br-CH=CH-CHBr-CH3.
.若该单烯烃继续发生消去反应,生成的产物与溴单质按1:1的比例加成,得到的所有产物的结构简式(不考虑立体异构)为:CH2BrCHBrCH=CHCH3、CH2=CH-CHBrCHBrCH3、CH2Br-CH=CH-CHBr-CH3.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两者都含s-s σ 键 | B. | 两者都含p-p σ 键 | ||
| C. | 前者含p-p σ 键,后者含s-p σ 键 | D. | 两者都含p-p π 键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电负性:④>③>②>① | B. | 最高正化合价:③>①>②>④ | ||
| C. | 原子半径:①>②>③>④ | D. | 第一电离能:④>③>②>① |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当金属全部溶解时,无法计算出参与反应的硝酸的物质的量 | |
| B. | 7.2<m<19.2 | |
| C. | 当金属全部溶解时,收集到NO气体的体积一定为4.48L | |
| D. | 当生成沉淀的量达到最大值时,消耗NaOH溶液的体积为120mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | c=$\frac{1000a}{22.4V}$ | |
| C. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω | |
| D. | 上述溶液中再加入1.5VmL同物质的量浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
查看答案和解析>>
科目: 来源: 题型:填空题
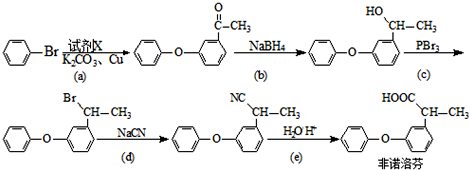
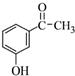 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com