
科目: 来源: 题型:选择题
| A. | NaHCO3溶液中加足量Ba(OH)2 溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| B. | 酸性溶液中KIO3与 KI反应生成 I2:IO3-+I-+6H+=I2+3H2O | |
| C. | NaHCO3 溶液与稀硫酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 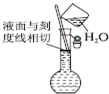 配制一定物质的量浓度溶液 | |
| B. | 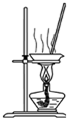 蒸干氯化锰溶液制MnCl2•4H2O | |
| C. | 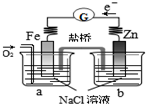 验证牺牲阳极的阴极保护,在a烧杯中滴入K3[Fe(CN)6]溶液,无蓝色沉淀产生 | |
| D. |  萃取时振荡溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
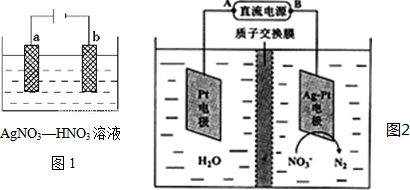
查看答案和解析>>
科目: 来源: 题型:解答题
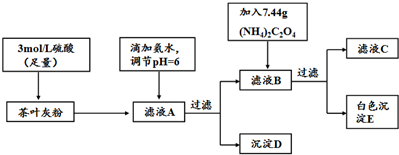
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 3.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
 (1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.
(1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.查看答案和解析>>
科目: 来源: 题型:选择题
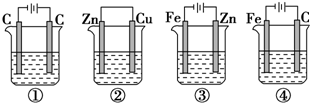
| A. | ②④ | B. | ②③ | C. | ④⑤ | D. | ①④ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com