
科目: 来源: 题型:选择题
| A. | 乙烯可用作水果的催熟剂 | |
| B. | 二氧化硫可用作食品的漂白剂 | |
| C. | 交警可用酸性重铬酸钾来检测司机是否酒驾 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:1:1 | B. | 3:2:3 | C. | 1:4:1 | D. | 3:2:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | △H1>△H2 | B. | △H1<△H2 | C. | △H1=△H2 | D. | 无法确定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 实验步骤 |
| A | 探究催化剂对化学反应速率的影响 | 向H2O2溶液中滴加少量FeCl3溶液 |
| B | 探究乙醇能发生氧化反应 | 将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C | 探究石蜡油分解的产物不都是烷烃 | 将石蜡油加强热产生的气体通入溴水中 |
| D | 探究浓度对反应速率的影响 | 取少量等质量的相同铁粉,分别加入1mol/L的硫酸和18mol/L的硫酸中,观察现象 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “恶狗酒酸”的成语中涉及了氧化反应 | |
| B. | 饮用的白酒是纯净物,即乙醇 | |
| C. | 酿酒过程中发生了物理变化和化学变化 | |
| D. | 工业酒精中因含有剧毒物质甲醇而不能用来勾兑饮用酒水 |
查看答案和解析>>
科目: 来源: 题型:实验题
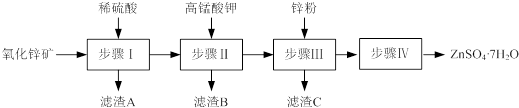
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
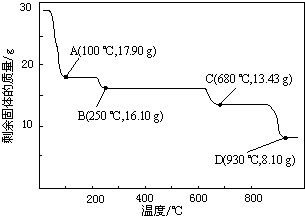
查看答案和解析>>
科目: 来源: 题型:实验题
| 软锰矿 | 闪锌矿 |
| MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分 | ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分 |
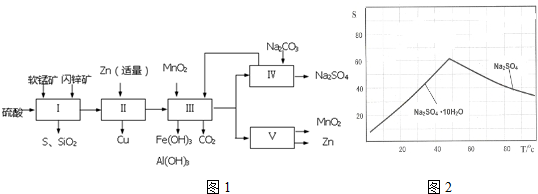
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 7.6 |
查看答案和解析>>
科目: 来源: 题型:实验题


查看答案和解析>>
科目: 来源: 题型:解答题
 .
.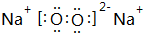 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com