
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
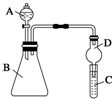 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH3易液化,液氨常作制冷剂 | |
| B. | NO、NO2都是有毒气体 | |
| C. | 铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处 | |
| D. | 稀HNO3和活泼金属反应时主要得到氢气 |
查看答案和解析>>
科目: 来源: 题型:解答题
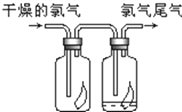 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cl2与水反应:Cl2+H2O═2H++ClO-+Cl- | |
| B. | CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 铁与盐酸反应:Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
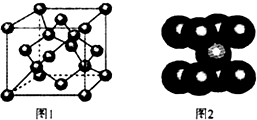 C、Be、Cl、Fe等元素及其化合物有重要的应用.
C、Be、Cl、Fe等元素及其化合物有重要的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com