
科目: 来源: 题型:推断题
| 元素编号 | 元素特征信息 |
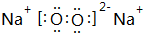
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
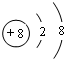 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
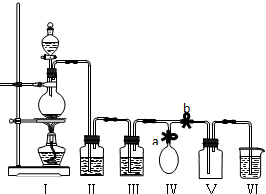
查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | 气体 | 除杂试剂 |
| A | CO2(HCl) | 盛饱和NaHCO3溶液的吸气瓶 |
| B | Cl2(HCl) | 盛饱和食盐水的吸气瓶 |
| C | NH3(H2O) | 盛碱石灰的球形干燥管 |
| D | SO2(HCl) | 盛饱和AgNO3溶液的吸气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入适量苯,振荡、静置后 现象:CCl4层呈橙红色. | 假设1正确 |
| ②向溶液中加入KSCN溶液溶液 现象:溶液变为红色. | 假设2正确 |
查看答案和解析>>
科目: 来源: 题型:解答题
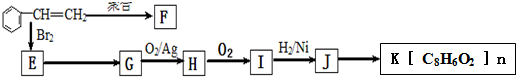
 ;J的分子式是C8H8O3.
;J的分子式是C8H8O3.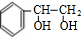 +O2$→_{△}^{Ag}$
+O2$→_{△}^{Ag}$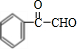 +2H2O;反应类型属于氧化反应
+2H2O;反应类型属于氧化反应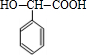 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$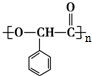 +n H2O
+n H2O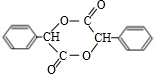 .
.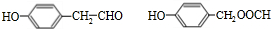 .
.查看答案和解析>>
科目: 来源: 题型:解答题
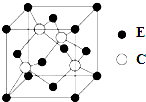 A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题:
A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | X气体 | Y溶液 | 预测的现象 |
| ① | CO2 | BaCl2溶液 | 白色沉淀析出 |
| ② | SO2 | Ba(N03)2溶液 | 白色沉淀析出 |
| ③ | Cl2 | AgNO3溶液 | 白色沉淀析出 |
| ④ | NH3 | FeCl2溶液 | 白色沉淀产生 |
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com