
科目: 来源: 题型:选择题
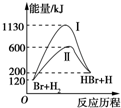
| A. | 反应热:过程Ⅰ>过程Ⅱ | |
| B. | 两个过程的反应热是相同的,△H=-80 kJ•mol-1 | |
| C. | 过程I中使用了催化剂 | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 悬浮物由黑色变为白色,因SO2是一种漂白剂 | |
| B. | 悬浮物由黑色变为白色,因为形成了PbSO4 | |
| C. | 有黄色沉淀生成 | |
| D. | 有臭鸡蛋味的气体放出 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(CH3COO-)+c(OH-)=0.10 mol•L-1 | B. | c(CH3COOH)+c(CH3COO-)=0.20 mol•L-1 | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | 温度为298 K时,pH<7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯酚与浓硝酸、浓硫酸反应生成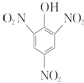 ,苯与浓硝酸、浓硫酸反应生成硝基苯 ,苯与浓硝酸、浓硫酸反应生成硝基苯 | |
| B. | 乙烯能发生加成反应,乙醇不能发生加成反应 | |
| C. | 苯酚能和氢氧化钠溶液反应,而乙醇不能和氢氧化钠溶液反应 | |
| D. | 苯酚苯环上的氢比苯分子中的氢更容易被卤素原子取代 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定有甲烷 | B. | 一定是甲烷和乙烯 | ||
| C. | 一定没有丙炔 | D. | 一定有乙炔 |
查看答案和解析>>
科目: 来源: 题型:选择题
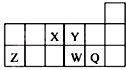
| A. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| B. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| C. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 | |
| D. | 元素Y的单质比元素X的单质更容易与氢气反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
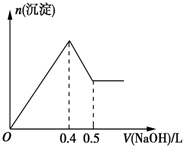 现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )| A. | 6:1 | B. | 2:3 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |
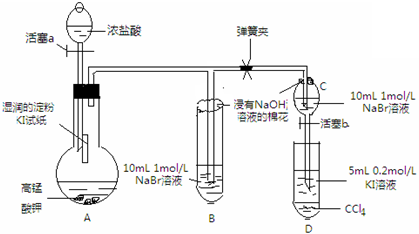
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4H的电子式为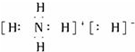 | |
| B. | NH4Cl的电子式为 | |
| C. | NH4H含有极性共价键和离子键 | |
| D. | NH4H固体投入少量热水中,有两种气体生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com