
科目: 来源: 题型:选择题
| A. | 原子半径:ra>rb>rc | B. | 微粒半径:Bn->An+ | ||
| C. | C元素不一定是稀有气体元素 | D. | 原子序数:C>B>A |
查看答案和解析>>
科目: 来源: 题型:解答题
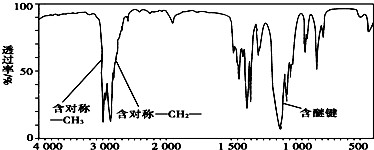
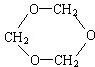
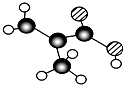 ,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).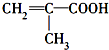 .
. 表示的有机物C的分子式为C6H14.
表示的有机物C的分子式为C6H14.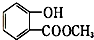 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | K+、Na+、NH4+、Fe2+、Ba2+、Cu2+ |
| 阴离子 | OH-、I-、NO3-、AlO2-、HCO3-、HSO4- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
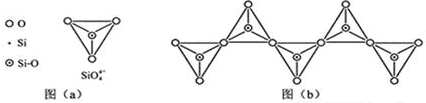
查看答案和解析>>
科目: 来源: 题型:解答题
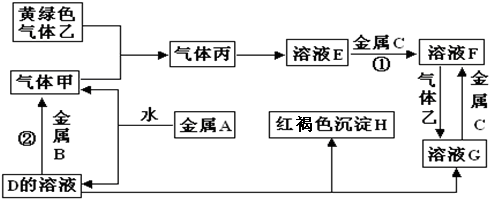
查看答案和解析>>
科目: 来源: 题型:解答题
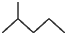
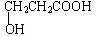 ;若甲能发生银镜反应,则甲的结构简式为
;若甲能发生银镜反应,则甲的结构简式为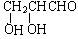 .
.
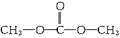 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1•min-1 | B. | 0.2 mol•L-1•min-1 | ||
| C. | 0.3 mol•L-1•min-1 | D. | 0.6 mol•L-1•min-1 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com