
科目: 来源: 题型:选择题
| 选项 | 离 子 | 要 求 |
| A | K+、AlO2-、Cl-、MnO4- | c(K+)<c(Cl-) |
| B | Fe3+、NO3-、I-、HCO3- | 逐滴加入盐酸立即有气体产生 |
| C | NH4+、Al3+、SO42-、CH2COOH | 逐滴加入NaOH溶液立即有气体产生 |
| D | Na+、Cu2、Cl-、SO42- | 逐滴加氨水先有沉淀产生,后沉淀消失 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D | |
| 方案 | 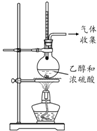 |  | 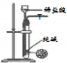 | 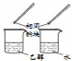 |
| 目的 | 利用乙醇的消去反应制取乙烯 | 蒸发NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量纯净的CO2气体 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:推断题

 .
.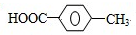 ,②化合物S可在一定条件下发生反应生成高聚物,写出该聚合反应方程式:
,②化合物S可在一定条件下发生反应生成高聚物,写出该聚合反应方程式: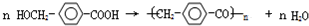 .
. 和
和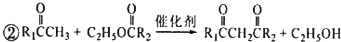 ,M的结构简式为
,M的结构简式为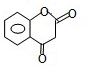 .
.查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
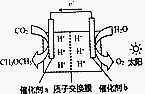 模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )| A. | H+由交换膜右侧向左侧迁移 | |
| B. | 催化剂a表面发生的反应是2CO2+12e-+12H+═CH3OCH3+3H2O | |
| C. | 该过程是太阳能转化为化学能的过程 | |
| D. | 消耗CO2与生成O2体积比为1:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 福尔马林滴入高锰酸钾溶液 | 紫色褪去 | 高锰酸钾被还原 |
| B | 氯化钠晶体导电实验 | 不导电 | 晶体不存在离子 |
| C | AgI悬浊液滴入Na2S溶液 | 固体变黑 | Ksp(Ag2S)>Ksp(AgI) |
| D | 测量H2CO3的电离常数 | Ka1>Ka2 | H2CO3一级电离产生的H+对二级的电离起抑制作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业通过分馏液态空气制备液氧 | |
| B. | 液氧不可燃,铁路旅客可以随身携带 | |
| C. | 液氧与液氢搭配做火箭推进剂的优点之一是清洁环保 | |
| D. | 沥青若长时间浸入液氧可能会发生爆炸 |
查看答案和解析>>
科目: 来源: 题型:实验题
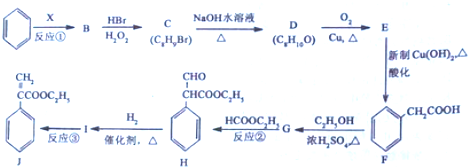
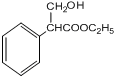 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$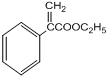 +H2O,反应类型是消去反应.
+H2O,反应类型是消去反应.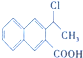 为起始原料制备
为起始原料制备 的合成路线(无机试剂任用).合成路线示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线(无机试剂任用).合成路线示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目: 来源: 题型:实验题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com