
科目: 来源: 题型:选择题
| A. | 氢氧燃枓电池、铅蓄电池、硅太阳能电池都利用了原电池原理 | |
| B. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| C. | 为防止重金属等污染土壤和水体,废电池应回收综合利用 | |
| D. | 用可降解的“玉米塑料”制作一次性饭盒,能减少“白色污染” |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 反应①配平后,H2O的化学计量数为4 | |
| B. | 若反应②有2mol电子发生转移,则生成1molNO3- | |
| C. | 反应③中生成物X为CO32- | |
| D. | 1L废水完全脱氮所需CH3OH的质量为0.08g |
查看答案和解析>>
科目: 来源: 题型:实验题
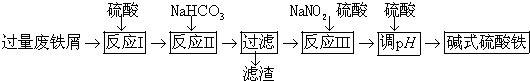
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目: 来源: 题型:实验题
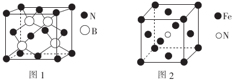
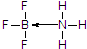 (标注出其中的配位键);利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图1为该晶体的晶胞结构,该功能陶瓷晶体的化学式为BN.
(标注出其中的配位键);利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图1为该晶体的晶胞结构,该功能陶瓷晶体的化学式为BN.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机层呈橙色 | 氧化性:Cl2>KBrO3 |
| B | 向KNO3和KOH混合溶液中加入铝粉并加热,将湿润的红色石蕊试纸放在试管口 | 试纸变为蓝色 | NO3-被还原为NH3 |
| C | 向0.1mol•L-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热. | 红色加深 | 盐类水解是吸热反应 |
| D | 将0.1mol•L-1的MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1的CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol丙烯中含有共价键的数目为0.6NA | |
| B. | 0.1mo Cl2全部溶于水后转移电子的数目为0.1NA | |
| C. | 标准状况下,2.24LSO3中含有氧原子的数目为0.3NA | |
| D. | 9.2g由乙醇和二甲醚(CH3OCH3)组成的混合物中含有氧原子的数目为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 相关说法 | 主要原因 |
| A | 包装内放置透气的硅胶包,有利于防止食品变质 | 硅胶有强吸水性 |
| B | 面粉加工车间悬挂有“严禁烟火”的牌子 | 烟火会污染面粉 |
| C | 某些铁制品出厂时在其表面涂上一层油膜可防止其生锈 | 铁被氧化,在其表面形成一层致密的保护膜 |
| D | 聚氯乙烯薄膜不能用于包装食品 | 会造成白色污染 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
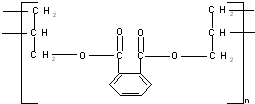
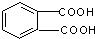 ⑤邻苯二甲酸甲酯
⑤邻苯二甲酸甲酯 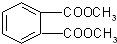
| A. | ①② | B. | ③④ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目: 来源: 题型:实验题
 太阳能电池板材料中除含有单晶体硅外,还含有铜、铁、硒等物质.
太阳能电池板材料中除含有单晶体硅外,还含有铜、铁、硒等物质.查看答案和解析>>
科目: 来源: 题型:选择题
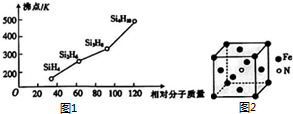
| A. | 图Ⅰ表法某放热反应过程中的能量变化,则曲线a可表示加入催化剂的反应 | |
| B. | 图Ⅱ表示两种盐的溶解度曲线,在较高温度下制得浓溶液再冷却结晶,过滤、洗涤、干燥可得纯净的固体a | |
| C. | 图Ⅲ表示相同pH的盐酸和醋酸分别用水稀释,则曲线a为醋酸 | |
| D. | 图Ⅳ表示相同物质的量浓度的NaOH溶液和氨水分别用盐酸滴定的曲线,则曲线a表示氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com