
科目: 来源: 题型:选择题
| A. | 明矾净水:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| B. | 用稀HNO3清洗试管内壁上的银:Ag+2H++NO3-═Ag++NO2↑+H2O | |
| C. | 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| D. | 焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
查看答案和解析>>
科目: 来源: 题型:填空题
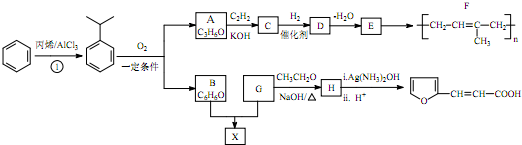
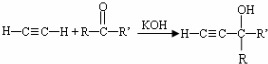
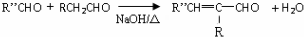 (-R、-R′、-R″表示可能相同或可能不同的原子或原子团)
(-R、-R′、-R″表示可能相同或可能不同的原子或原子团)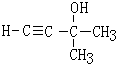 .
.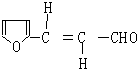 ,H的同分异构体中属于芳香族化合物的共有5种.
,H的同分异构体中属于芳香族化合物的共有5种.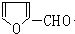 +CH3CHO$→_{△}^{NaOH}$
+CH3CHO$→_{△}^{NaOH}$ +H2O.
+H2O. .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| B. | 将过量二氧化硫气体通入氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| C. | 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO${\;}_{3}^{2-}$═CaCO3↓+SO${\;}_{3}^{2-}$ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO${\;}_{3}^{-}$═3Ag++NO↑+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 | |
| B. | 75%的酒精可使蛋白质变性从而起到消毒作用 | |
| C. | 纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 | |
| D. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | A | B | C | D |
| 原文 | 水火既济而土和 | 以曾青凃铁,铁赤色如铜 | 丹砂烧之成水银,积变又还成丹砂 | 欲去杂还纯,再入水煎炼,倾入盆中,经宿成白雪 |
| 解释 | 黏土烧结成陶瓷 | 金属的置换 | 物质间转化的可逆性 | 重结晶方法提纯物质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 增加某一反应物的用量一定能够加快该反应的速率 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 化学反应达到限度时,正逆反应速率相等 | |
| D. | 化学反应进行的时间越长该反应的限度越大 |
查看答案和解析>>
科目: 来源: 题型:实验题
 (1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.
(1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乳酸 CH3-CHOH-COOH | |
| B. | 甘油 CH2OH-CHOH-CH2OH | |
| C. | 脱氧核糖 CH2OH-CHOH-CHOH-CH2-CHO | |
| D. | 核糖 CH2OH-CHOH-CHOH-CHOH-CHO |
查看答案和解析>>
科目: 来源: 题型:实验题
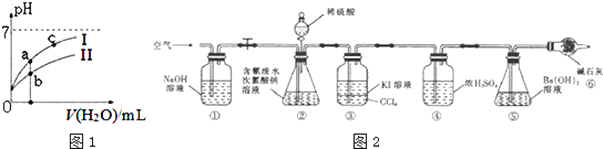
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:实验题
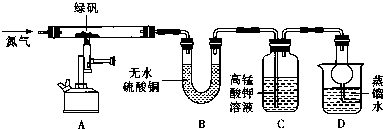
| 装置 | 现象 | 结论 |
| A | 固体呈红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液 | |
| B | 无水硫酸铜变蓝 | |
| C | 高锰酸钾溶液褪色 |
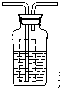 瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com