
科目: 来源: 题型:选择题
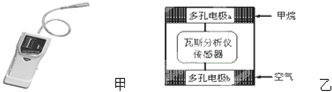
| A. | 电极b是正极,O2-由电极a流向电极b | |
| B. | 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a | |
| C. | 当固体电解质中有1 mol O2-通过时,电子转移4 mol | |
| D. | 电极a的反应式为:CH4+5O2--8e-═CO32-+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铜片与浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O | |
| B. | 向漂白精溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | H2C2O4溶液能使KMnO4酸性溶液褪色 2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| D. | 向Fe(NO3)2溶液中加入过量的HI溶液 3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用铜作电极电解饱和食盐水,当线路中通过NA个电子时,阳极生成11.2L气体(标准状况下) | |
| B. | 把5.6g铁片投入到足量的冷的浓硝酸中,转移电子数为0.3NA | |
| C. | 12g石墨晶体中含有碳碳单键数为1.5NA | |
| D. | 15g-CH3中含有的电子数为10NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质都能发生水解 | |
| B. | Na2CO3、NaHCO3可用作食用碱或工业用碱 | |
| C. | “地沟油”禁止食用,但可以用来制肥皂或生产燃料油 | |
| D. | 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯 |
查看答案和解析>>
科目: 来源: 题型:推断题
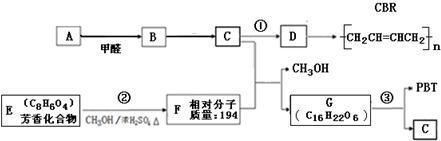
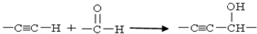
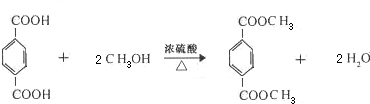 .E有多种芳香族同分异构体,其中红外光谱显示分子中含“-COO-”,核磁共振氢谱显示3个吸收峰,且峰面积之比为1:1:1的结构简式是
.E有多种芳香族同分异构体,其中红外光谱显示分子中含“-COO-”,核磁共振氢谱显示3个吸收峰,且峰面积之比为1:1:1的结构简式是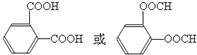 .
.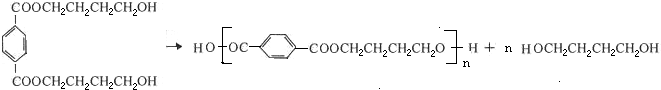 .
.查看答案和解析>>
科目: 来源: 题型:实验题
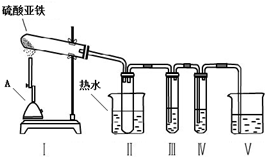
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 KSCN溶液(或B). | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加 2滴黄色K3[Fe(CN)6]溶液. | 产生蓝色沉淀 | 固体中含有FeO |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 71 | 74 | 77 | 186 |
| 主要化合价 | +1 | -1 | -2 | +4、-4 | +1 |
| A. | X和Q都属于金属元素 | |
| B. | Y和Z的基态原子s能级和p能级电子数相同 | |
| C. | Y和W的第一电离能大小比较:Y>W | |
| D. | X、Z形成的化合物分子中可能既有σ键又有π键 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
| 操作 | 应该观察到的现象 |
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com