
科目: 来源: 题型:选择题
| A. | 分子是不可再分的 | B. | 分子只有在特定的季节才会运动 | ||
| C. | 分子是不停运动的 | D. | 分子只有在特定的空间才会运动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4L 水中所含原子总数为3NA | |
| B. | 1molNa2O2与足量CO2反应转移的电子数2NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
科目: 来源: 题型:实验题
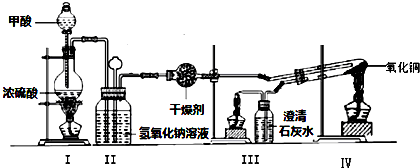
查看答案和解析>>
科目: 来源: 题型:推断题
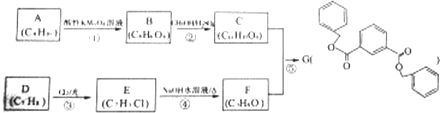
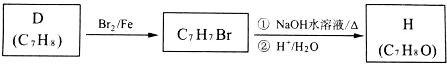
 .
.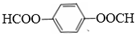 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | MgSO4溶液中加入Ba(OH)2溶液:SO42-+Ba2+═BaSO4↓ | |
| C. | NaHCO3溶液加入少量Ca(OH)2溶液:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 硫化钠溶液显碱性:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用活性炭除去冰箱中的异味是发生了化学反应 | |
| B. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 | |
| C. | 碘是人体必需微量元素,所以要多吃富含碘化钾的食物 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 步骤 | 试剂及操作 | 现 象 |
| i | 取2 mL BaCl2溶液,滴加2滴0.1 mol•L-1KSCN溶液和5滴5% H2O2溶液 | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1mol•L-1 FeCl3溶液 | 无明显现象 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,向醋酸钠溶液中滴加盐酸至溶液呈中性一定有:c(CH3COOH)=c(Cl-) | |
| B. | NaHSO4溶液中滴加Ba(OH)2至溶液恰好呈中性c(Na+)>c(SO42-)>c(OH-)=c(H+) | |
| C. | 某酸式盐NaHA溶液中一定有:c(OH-)+c(A2-)=c(H+)+c(H2A) | |
| D. | 0.5 mol/L 的Na2S溶液中:$\frac{1}{2}$ c(Na+)=c(H2S)+c(HS-)+c(S2-)=0.5 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com