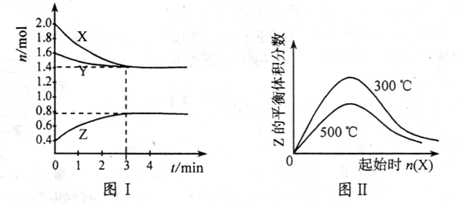
(2012?绵阳模拟)我国生活饮用水水质标准规定锰元素不得超过0.1mg/L.水体中的锰主要以Mn2+存在,可通过放大反应法测定自来水中Mn
2+的含量,根据下列测定步骤回答问题.
步骤一:配制500mL0.10mol/L硫代硫酸钠 (Na
2S
2O
3)标准溶液.
(1)需要称取
7.9
7.9
g硫代硫酸钠固体,配制过程中,必须用到的玻璃仪器有
烧杯、玻璃棒、500mL容量瓶、胶头滴管
烧杯、玻璃棒、500mL容量瓶、胶头滴管
,下列操作会使所配溶液浓度偏低的是
ACE
ACE
(填下列选项的字母序号).
A.称取硫代硫酸钠固体时,将硫代硫酸钠固体放在托盘天平右盘
B.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
C.未将洗涤烧杯内壁的溶液转入容量瓶
D.定容时俯视刻度线
E.定容时,不小心加水超过刻度线,立即用胶头滴管吸出多余的水
步骤二:取50.0mL自来水样品放入锥形瓶中,加入适量H
2 SO
4酸化,然后加入过量的KIO
4,发生反应
2Mn
2++5IO
4-+3H
2O═2MnO
4-+5IO
3-+6H
+多余的KIO
4通过加入掩蔽剂来消除干扰.再加入足量的KI溶液,使之与上述反应生成的MnO
4-,IO
3-反应,制得待测液.
(2)加入足量的KI溶液时,发生反应的离子方程式分别是:2MnO
4-+10I
-+16H
+═2Mn
2++5I
2+8H
2 O、
IO3-+5I-+6H+═3I2+3H2O
IO3-+5I-+6H+═3I2+3H2O
步骤三:用稀释至0.0010mol/L的硫代硫酸钠溶液滴定上述待测液,发生反应:I
2+2Na
2S
2O
3═2NaI+NaS
4O
6达到滴定终点时消耗Na
2S
2O
3溶液12.00mL
(3)滴定操作时,用
淀粉溶液
淀粉溶液
作指示剂,达到滴定终点的现象为
溶液由蓝色变为无色,且半分钟不恢复
溶液由蓝色变为无色,且半分钟不恢复
,测得自来水样品中锰元素的含量为
0.66
0.66
mg/L,该自来水不符合我国生活饮用水水质标准.

 CH3COOH+OH-
CH3COOH+OH- CH3COOH+OH-
CH3COOH+OH-