
科目: 来源: 题型:实验题
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 滴定次数 | 盐酸体积(ml) | NaOH溶液体积读数(ml) | |
| 滴定前 | 滴定后 | ||
| 20.00 | 0.00 | 16.30 | |
| 2 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目: 来源: 题型:实验题


查看答案和解析>>
科目: 来源: 题型:选择题
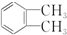 )加氢产物1,2二甲基环己烷(
)加氢产物1,2二甲基环己烷( )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )| A. | 5种 | B. | 6种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH3+H3O+═NH${\;}_{4}^{+}$+H2O:NH3结合H+的能力比H2O强 | |
| B. | Al2O3+2NaOH═2NaAlO2+H2O:Al2O3是两性氧化物 | |
| C. | HClO+SO2+H2O═HCl+H2SO4:酸性 HClO>H2SO4 | |
| D. | 已知C(s,石墨)=C(s,金刚石)△H=+1.9 kJ/mol:金刚石比石墨稳定 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | pH=3的醋酸与pH=11的氢氧化钠溶液等体积混合所得溶液的pH<7 | |
| B. | 反应2CO(g)+2H2(g)→CH3COOH (l)的△S>0 | |
| C. | 冰醋酸用水稀释,溶液中c(H+)先变大后变小 | |
| D. | 含有CH3COOH、C2H5OH、CH3COOC2H5及H2O的平衡体系中加入少量浓硫酸,CH3COOC2H5的物质的量不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铜片投入FeCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | AgCl悬浮液中加入Na2S溶液沉淀变黑:2AgCl+S2-═Ag2S+2Cl- | |
| C. | 用两根铁电极电解CuSO4溶液:2Cu 2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ | |
| D. | Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目: 来源: 题型:实验题
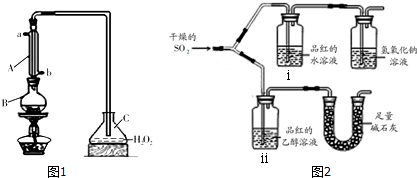
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 装置 图 | 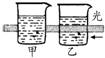 |  | 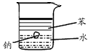 | 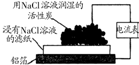 |
| 主要 现象 | 乙装置中有光亮通路,甲装置无明显现象 | 两试管中都有气泡产生,但乙比甲速率快 | 钠在水与苯层之间上下跳动,且有气泡产生 | 电流表指针发生偏转 |
| 实验 结论 | 乙装置中分散系为胶体,甲装置中分散系不是胶体 | 可验证FeCl3对H2O2分解反应有催化作用 | 证明密度ρ(苯)<ρ(钠)<ρ(水) | 电子从铝箔流出,经电流表、流到活性炭 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )| A. | 该电池可将化学能转化为电能 | |
| B. | 每有0.1 mol O2反应,则迁移0.4 mol H+ | |
| C. | 正极反应式为:CH2=CH2-2e-+2OH-═CH3CHO+H2O | |
| D. | 负极区溶液的pH减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应 | |
| B. | 配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸 | |
| C. | NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强 | |
| D. | 0.1 mol/L CH3COOH溶液加水稀释后,CH3COOH的电离程度和溶液中c(OH-)都增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com