
科目: 来源: 题型:解答题
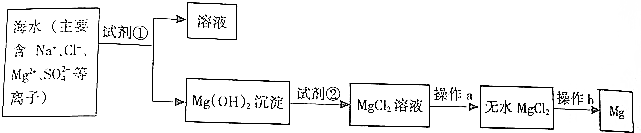
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2 | B. | CO2 | C. | Cl2 | D. | O2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硝酸浓度越大消耗的硝酸越少,产生的有毒气体也越少 | |
| B. | 反应中转移的电子总数稀硝酸少 | |
| C. | 试管内壁上的铜用浓硝酸除好,因反应速率快 | |
| D. | 两者用排水法收集的气体的体积相同 |
查看答案和解析>>
科目: 来源: 题型:多选题
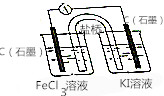 按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )
按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )| A. | 左侧石墨为电池的正极,电极反应:Fe3++e-═Fe2+ | |
| B. | 右侧烧杯中发生还原反应,电极反应:2I--2e-═I2 | |
| C. | 右侧烧杯内溶液颜色变浅 | |
| D. | 盐桥中的K+流向右侧烧杯 |
查看答案和解析>>
科目: 来源: 题型:实验题
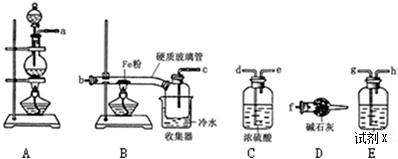
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:推断题
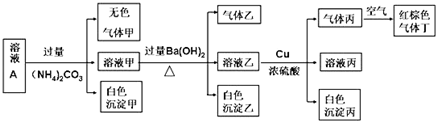
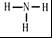 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com