
科目: 来源: 题型:推断题
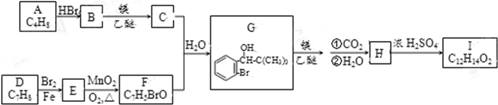
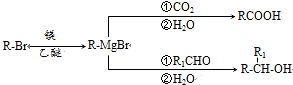
 .
. .
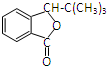
.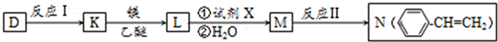
 .
.查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,16 g O2和32g O3的混合物中,含有O原子数目为3NA | |
| B. | 标准状况下,1 mol Na2O和1 mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1 mol NaBH4中离子键的数目为2NA | |
| D. | 在K35ClO3+6H37Cl═KCl+3Cl2↑+3H2O中,若生成71 g Cl2,转移的电子数目为$\frac{5}{3}$NA |
查看答案和解析>>
科目: 来源: 题型:实验题
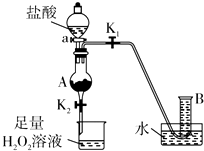 氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):
氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):查看答案和解析>>
科目: 来源: 题型:推断题
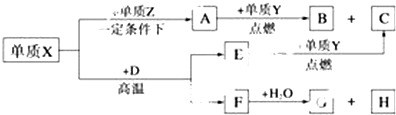
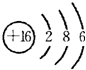 ,A的电子式
,A的电子式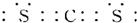 .
.查看答案和解析>>
科目: 来源: 题型:选择题
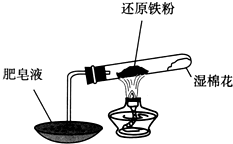
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
| A. | 试管内的固体一定含有铁粉 | |
| B. | 试管内的固体一定不含有Fe3O4 | |
| C. | 不能确定试管内的固体一定含有FeO | |
| D. | 可通过将试管内固体彻底还原,分析其质量减小的方法来确定是否含有Fe3O4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 | |
| B. | 乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 | |
| C. | 丙中含有第2周期ⅣA 族的元素,则丙可能是甲烷的卤代物 | |
| D. | 丁和甲中各元素质量比相同,则丁可能是C2H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.8g重水(D2O)中含有的中子数为NA | |
| B. | 1molCl2参加氧化还原反应,转移的电子数一定为2NA | |
| C. | T℃时pH=6的纯水中,含有10-6 NA个OH- | |
| D. | 电解精炼铜时,若转移NA个电子,阴极析出32 g铜 |
查看答案和解析>>
科目: 来源: 题型:填空题
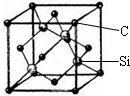 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若a=b且c(X-)=c(Y-)+c(HY),则HX为强酸 | |
| B. | 若a=b且pH(NaX)>pH(NaY),则c(X-)+c(OH-)>c(Y-)+c(OH-) | |
| C. | 若a>b且c(X-)=c(Y-),则酸性HX>HY | |
| D. | 若两溶液等体积混合,则c(Na+)=(a+b) mol/L(忽略混合过程中的体积变化) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com