
科目: 来源: 题型:选择题
| A. | 若某温度下,反应后c(Cl-):c(ClO-)=11,则溶液中c(ClO-):c(ClO3-)=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:$\frac{1}{2}$ amol≤n≤$\frac{5}{6}$amol | |
| D. | 改变温度,产物中KC1O3的最大理论产量为$\frac{1}{7}$amol |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 因为氯化铝是分子晶体,所以工业制备金属铝不采用电解氯化铝溶液,但工业制取金属镁可以采用电解氯化镁溶液的方法 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体c(Mg2+)增大 | |
| C. | 鸡蛋清中加入2滴1%醋酸铅溶液后会产生沉淀,因为蛋白质发生了变性 | |
| D. | 在BaSO4悬浊液中加入饱和碳酸钠溶液,过滤、洗涤得固体,再加盐酸产生气体.可证明Ksp(BaSO4)<Ksp(BaCO3) |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
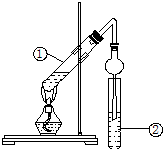 某同学用如图所示实验装置制取乙酸乙酯.在试管①中先加入3mL95%的乙醇,并在摇动下缓缓加入2mL浓硫酸和2mL醋酸.用玻璃棒充分搅拌后将试管固定在铁架台上,在试管②中加入5mL饱和Na2CO3溶液,按图连接装置,用酒精灯对试管①加热,当观察到试管②中有明显现象时停止实验.
某同学用如图所示实验装置制取乙酸乙酯.在试管①中先加入3mL95%的乙醇,并在摇动下缓缓加入2mL浓硫酸和2mL醋酸.用玻璃棒充分搅拌后将试管固定在铁架台上,在试管②中加入5mL饱和Na2CO3溶液,按图连接装置,用酒精灯对试管①加热,当观察到试管②中有明显现象时停止实验.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
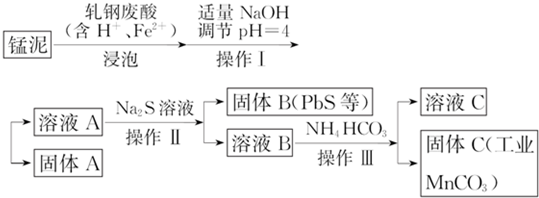
查看答案和解析>>
科目: 来源: 题型:解答题
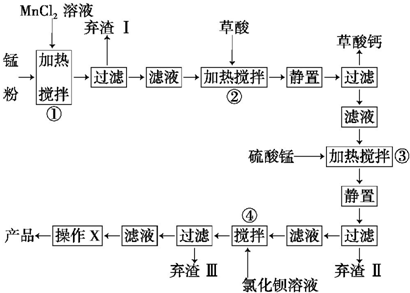
查看答案和解析>>
科目: 来源: 题型:解答题
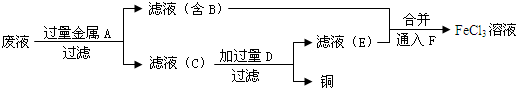
查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | pH (开始沉淀) | pH(完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
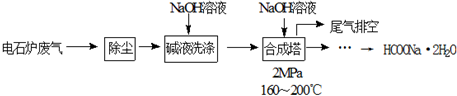
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com