
科目: 来源: 题型:选择题
| A. |  如图夹紧弹簧夹,由漏斗中加水至产生液面差,一段时间后液面差不变,说明气密性良好 | |
| B. | 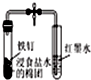 如图打开弹簧夹,红墨水倒吸入导气管中,说明铁钉发生了吸氧腐蚀 | |
| C. | 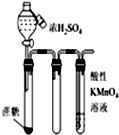 如图滴入浓硫酸后,高锰酸钾溶液褪色,说明浓硫酸使蔗糖脱水的同时还产生了二氧化碳 | |
| D. | 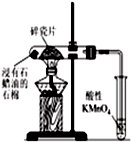 如图加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了氧化还原反应 | |
| B. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| C. | 利用植物油的氧化反应可以获得人造脂肪 | |
| D. | 干燥剂硅胶和硅橡胶的主要成分都是二氧化硅 |
查看答案和解析>>
科目: 来源: 题型:选择题
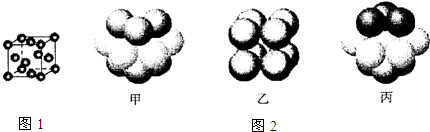
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
查看答案和解析>>
科目: 来源: 题型:推断题
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温常压下是气体.原子的M层上有1个未成对的p电子. |
查看答案和解析>>
科目: 来源: 题型:实验题
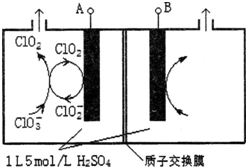 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.查看答案和解析>>
科目: 来源: 题型:实验题
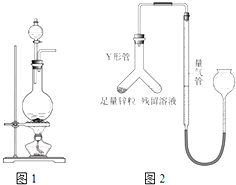 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).查看答案和解析>>
科目: 来源: 题型:解答题
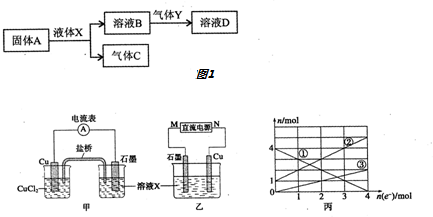
 .
. .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHCO3溶液 | B. | NaOH溶液 | C. | KSCN溶液 | D. | 氨水 |
查看答案和解析>>
科目: 来源: 题型:解答题
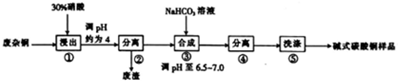
查看答案和解析>>
科目: 来源: 题型:解答题
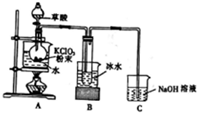 二氧化氯(ClO2)是一种高效消毒剂,在60℃时用氯酸钾与草酸(中强酸)反应可制备二氧化氯,实验装置如图所示.已知:通常情况下,二氧化氯的沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质确定的气体稀释,以防爆炸,回答下列问题:
二氧化氯(ClO2)是一种高效消毒剂,在60℃时用氯酸钾与草酸(中强酸)反应可制备二氧化氯,实验装置如图所示.已知:通常情况下,二氧化氯的沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质确定的气体稀释,以防爆炸,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com