
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:推断题
 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.查看答案和解析>>
科目: 来源: 题型:推断题
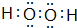 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 冰的密度比水小,能浮在水面上 | |
| B. | 接近沸点的水蒸气的相对分子质量测量值大于18 | |
| C. | 邻羟基苯甲醛的沸点低于对羟基苯甲醛 | |
| D. | H2O比H2S稳定 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 化学反应可分为吸热反应和放热反应 | |
| B. | 化学反应的实质是旧键的断裂与新键的生成 | |
| C. | 化学反应中的能量变化都是以热能的形式表现出来 | |
| D. | 放热反应发生时不需加热 |
查看答案和解析>>
科目: 来源: 题型:解答题
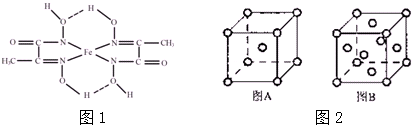
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com