
科目: 来源: 题型:选择题
| A. | 元素非金属性由强到弱的顺序:Z、W、X | |
| B. | 原子半径由大到小的顺序:W、Z、Y、X | |
| C. | 原子最外层电子数由多到少的顺序:Y、X、W、Z | |
| D. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y、W |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1 Na2CO3溶液中CO32-、HCO3-和H2CO3总数为0.1 NA | |
| B. | NaCl的沸点为1465℃,1500℃时气体摩尔体积是Vm,此状态下,3Vm L的氯化钠含有3 NA个共价键 | |
| C. | 25℃,1 L pH=1的稀硫酸中含有的H+数为0.1 NA | |
| D. | 1 mol Cu和足量稀硝酸反应产生$\frac{2}{3}$ NA个NO分子 |
查看答案和解析>>
科目: 来源: 题型:推断题
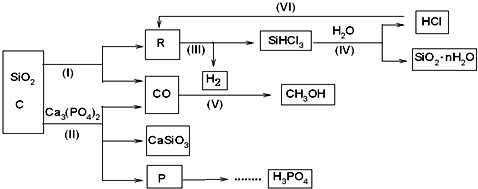
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 8.15 | B. | 9.3 | C. | 10.15 | D. | 11.6 |
查看答案和解析>>
科目: 来源: 题型:实验题
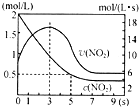 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: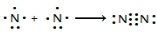 .
.| 化学键 | N-H | N-N | N═N | N≡N | O═O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目: 来源: 题型:选择题
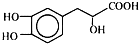
| A. | 丹参素在C上取代H的一氯代物有4种 | |
| B. | 在Ni催化下1 mol丹参素最多可与4 mol H2加成 | |
| C. | 丹参素能发生取代、消去、中和、氧化等反应 | |
| D. | 1 mol丹参素在一定条件下与足量金属钠反应可生成4 mol H2 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | W点所示的溶液中:c(Na+)+c(H+)═2c(CO32-)+c(OH-)+c(Cl-) | |
| B. | pH=4的溶液中:c(H2CO3)+c(HCO32-)+c(CO32-)<0.1 mol•L-1 | |
| C. | pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)═c(OH-)+c(Cl-) | |
| D. | pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3- )>c(H2CO3) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,22.4 L乙烯中C-H键数为4NA | |
| B. | 1 mol羟基中电子数为10NA | |
| C. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| D. | 常温下,1 L 0.1 mol•L-1 的NH4NO3溶液中氮原子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com