
科目: 来源: 题型:选择题
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | |
| B. | R与Q的电子数相差18 | |
| C. | 气态氢化物稳定性:R<T<Q | |
| D. | 最高价氧化物对应水化物的酸性:T>Q |
查看答案和解析>>
科目: 来源: 题型:选择题
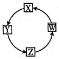 X、Y、Z、W四种物质间的转化关系如图所示,下列转化关系中不能一步实现的是
X、Y、Z、W四种物质间的转化关系如图所示,下列转化关系中不能一步实现的是| 选项 | X | Y | Z | W |
| A | Na | Na2O2 | NaOH | NaCl |
| B | H2S | SO2 | SO3 | H2SO4 |
| C | Fe | FeCl3 | Fe(OH)3 | Fe2O3 |
| D | AlCl3 | NaAlO2 | Al(OH)3 | Al |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若铁粉有剩余,则不溶物中一定有铜 | |
| B. | 若铁粉有剩余,则溶液中的金属阳离子只有Fe2+ | |
| C. | 若铁粉无剩余,且溶液中有Cu2+,则溶液中一定无Fe3+ | |
| D. | 若铁粉无剩余,且溶液中无Cu2+,则溶液中一定有Fe2+,一定无Fe3+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ④②⑤①③ | D. | ⑤②④①③ |
查看答案和解析>>
科目: 来源: 题型:解答题

| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,其最简单气态氢化物的稳定性小于(填“大于”或“小于”)NH3.
,其最简单气态氢化物的稳定性小于(填“大于”或“小于”)NH3.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、S2-、Cl- | ||
| C. | K+、NH4+、MnO4-、SO42- | D. | Na+、K+、NO3-、HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
| A. | KBr | B. | KI | C. | K2S | D. | K2CrO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com