
科目: 来源: 题型:解答题
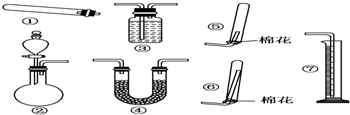
查看答案和解析>>
科目: 来源: 题型:解答题
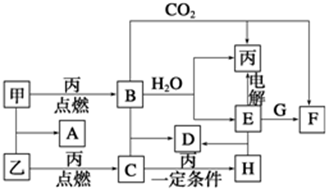
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1×10-5mol/L | B. | 1×10-12mol/L | C. | 1×10-6mol/L | D. | 1×10-7mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳酸钠(s) | B. | 醋酸钠(s) | C. | 亚硫酸钠(aq) | D. | 硝酸钾(aq) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入的碱溶液体积大 | B. | 酸和碱溶液体积相等 | ||
| C. | 加入的碱溶液体积小 | D. | 以上情况都有可能 |
查看答案和解析>>
科目: 来源: 题型:解答题
| a | b | ||||||||||||||||
| d | e | f | |||||||||||||||
| c | g | h | |||||||||||||||
| A | B | C | D | ||||||||||||||
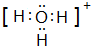
查看答案和解析>>
科目: 来源: 题型:解答题
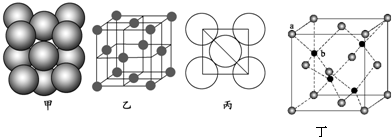
查看答案和解析>>
科目: 来源: 题型:解答题
 X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com