
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.7 | 7.5 | 5.4 | 4.0 | 6.4 |
| 完全沉淀时的pH | 3.7 | 9.5 | 6.6 | 5.2 | 8.0 |
查看答案和解析>>
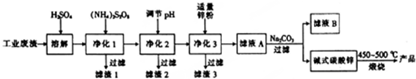
科目: 来源: 题型:解答题
查看答案和解析>>
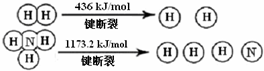
科目: 来源: 题型:解答题
查看答案和解析>>
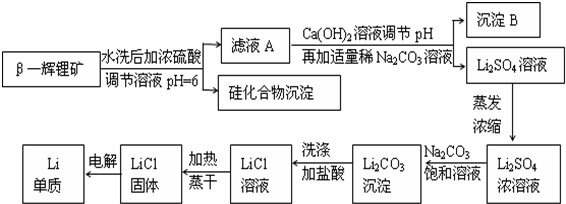
科目: 来源: 题型:解答题
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极.接通电源,经过一段时间后,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极.接通电源,经过一段时间后,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
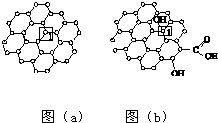 石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除去石英中混有的少量铝粉,可加入氢氧化钠溶液溶解后过滤 | |
| B. | 向含少量FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取,以除去FeCl2溶液中的FeBr2 | |
| C. | 除去乙酸乙酯中混有的少量乙酸,加入饱和氢氧化钠溶液振荡后分液 | |
| D. | 除去CuCl2溶液中混有的少量FeCl3,可向溶液中加入CuO后再过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com