
科目: 来源: 题型:选择题
| A. | 氢键是化学键 | |
| B. | 甲烷可与水形成氢键 | |
| C. | 乙醇分子跟水分子之间存在范德华力和氢键 | |
| D. | 碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键 |
查看答案和解析>>
科目: 来源: 题型:解答题
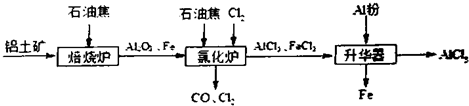
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
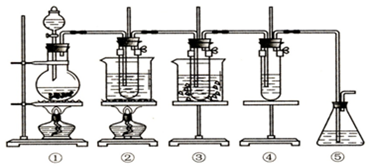
查看答案和解析>>
科目: 来源: 题型:解答题
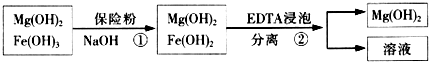
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.2 | 0.2 | pH=9 |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
| A. | c1=0.2 | |
| B. | 丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-) | |
| C. | a>9 | |
| D. | 在乙组混合液中由水电离出的c(OH-)=10-5mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 每个水分子内含有两个氢键 | |
| B. | 只要有氢元素就能形成氢键 | |
| C. | 分子间能形成氢键使物质的熔点和沸点升高 | |
| D. | HF的稳定性很强,是因为其分子间能形成氢键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①和② | B. | ② | C. | ③和④ | D. | 以上都不对 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3.36 L | B. | 4.48 L | C. | 5.6 L | D. | 6.72 L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaOH | B. | H2SO4 | C. | Na2CO3 | D. | Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com