
科目: 来源: 题型:解答题
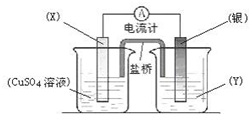 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目: 来源: 题型:实验题
 .
.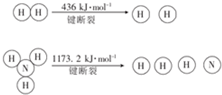
| n(N2)/mol | N(H2)/mol | N(NH3)/mol | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
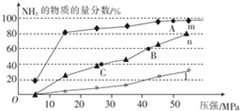
查看答案和解析>>
科目: 来源: 题型:选择题
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | K=6.61×10-4 |
| A. | 氰化钠溶液中通入少量CO2:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN-)>c(HCN)>c(H+)>c(OH+) | |
| C. | 0.2 mol•L-1 HCN溶液与0.1mol•L-1NaOH溶液等体积混合后,溶液中各种离子的浓度关系有:2[c(H+)-c(OH+)]=c(CN+)-c(HCN) | |
| D. | 等体积、等浓度的NaCN和NaF溶液中所含离子总数前者大于后者 |
查看答案和解析>>
科目: 来源: 题型:推断题
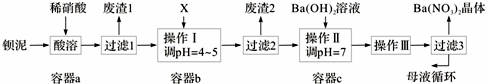
查看答案和解析>>
科目: 来源: 题型:实验题
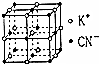 六氰合铁(Ⅲ)酸钾K3[Fe(CN)6]俗称赤血盐,在医药工业、印染工业及钢铁工业均有重要作用,请回答下列问题:
六氰合铁(Ⅲ)酸钾K3[Fe(CN)6]俗称赤血盐,在医药工业、印染工业及钢铁工业均有重要作用,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题
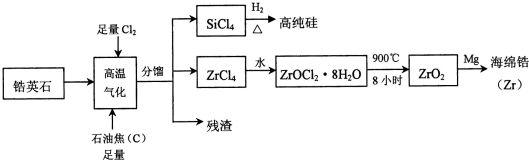
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
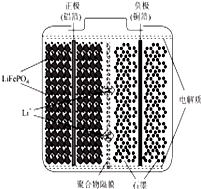 锂离子电池广泛应用与日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新呈”.
锂离子电池广泛应用与日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新呈”.查看答案和解析>>
科目: 来源: 题型:选择题
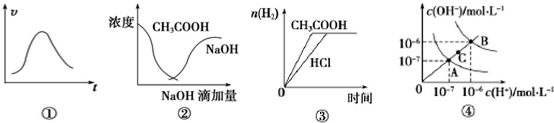
| A. | 图①可表示一定条件下,锌和稀硫酸反应的速率随时间变化的趋势图 | |
| B. | 图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液中浓度的变化趋势图 | |
| C. | 图③表示等体积、等物质的量浓度的盐酸和醋酸,分别加足量镁粉,产生H2的物质的量变化 | |
| D. | 图④为水的电离平衡曲线图,若从A点到C点,可采用升高温度的方法 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| B. | 为增强氯水的漂白性,可以向其中加入碳酸钙 | |
| C. | NaH与重水反应的方程式:NaH+D2O═NaOH+D2↑ | |
| D. | 均含有NA个电子的H2O和CH4具有相同的体积 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有食品添加剂的物质均对人体健康有害 | |
| B. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| C. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl | |
| D. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com