
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 增大空气进入量或减小石油气进入量 | |
| B. | 增大空气进入量,增大石油气进入量 | |
| C. | 减小空气进入量,减小石油气进入量 | |
| D. | 减小空气进入量或增大石油气进入量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通入CH4的电极为正极 | |
| B. | 正极的电极反应式为O2+4H++4e-═2H2O | |
| C. | 通入CH4的一极的电极反应式为CH4+2O2+4e-═CO2+2H2O | |
| D. | 负极的电极反应式为CH4+10OH--8e-═CO32-+7H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 12mol2•L-2 | B. | 16mol2•L-2. | C. | 20mol2•L-2 | D. | 25mol2•L-2 |
查看答案和解析>>
科目: 来源: 题型:选择题
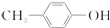 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )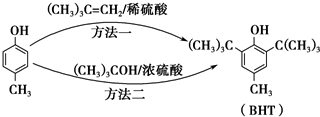
| A. | 推测BHT在水中的溶解度小于苯酚 | |
| B. | 方法一和方法二的反应类型都是加成反应 | |
| C. | BHT与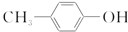 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| D. | BHT与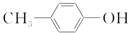 具有完全相同的官能团 具有完全相同的官能团 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 选项 | 实验 | 解释或结论 |
| A | 向包有Na2O2的脱脂棉滴少量水,脱脂棉燃烧 | Na2O2与H2O反应放热并有O2生成 |
| B | 向NaI溶液滴加FeCl3溶液,再加入CCl4,振荡,静置,下层呈紫红色 | 氧化性:I2>Fe3+ |
| C | 取酸雨试样,滴加H2O2溶液,再加入BaCl2溶液,有白色沉淀 | 该酸雨试样中一定含有H2SO3 |
| D | 用激光笔照射水玻璃(Na2SiO3的溶液),有丁达尔现象 | SiO32-水解生成了硅酸胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 用惰性电极电解氯化钠溶液:4Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cl2↑+2H2↑+O2↑ | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | NaHCO3溶液中与滴加少量Ca(OH)2溶液:CO32-+Ca2+═CaCO3↓ |
查看答案和解析>>
科目: 来源: 题型:解答题
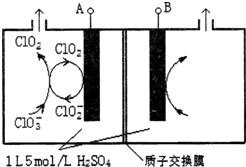 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com