
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
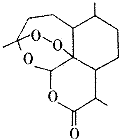 2015年10月5日,中国科学家屠哟坳首次获诺贝尔生理学或医学奖,以表彰她创制新型抗疟药-青蒿素和双氢青蒿素,其中青蒿素的结构简式如图所示,则青蒿素分子中碳、氧原子的个数比为( )
2015年10月5日,中国科学家屠哟坳首次获诺贝尔生理学或医学奖,以表彰她创制新型抗疟药-青蒿素和双氢青蒿素,其中青蒿素的结构简式如图所示,则青蒿素分子中碳、氧原子的个数比为( )| A. | 2:1 | B. | 3:1 | C. | 12:5 | D. | 16:5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | B位于元素周期表中第二周期第ⅥA族 | |
| B. | 工业上可以用电解CE溶液的方法同时获得C、E单质 | |
| C. | C、D的最高价氧化物对应的水化物之间能发生化学反应 | |
| D. | 化合物AE与CE具有相同类型的化学键 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
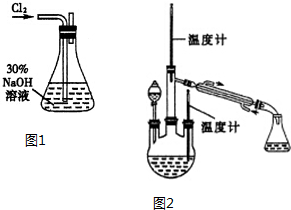 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H20).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H20).查看答案和解析>>
科目: 来源: 题型:解答题
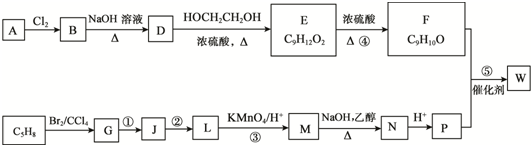
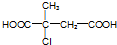 .
. (R1~R4表示烃基)
(R1~R4表示烃基) .
.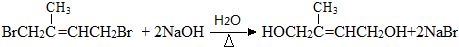 .
. .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
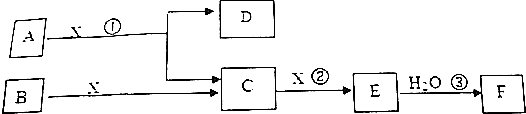
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com