
科目: 来源: 题型:解答题
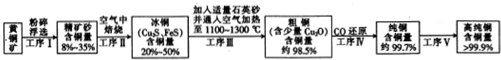
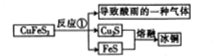
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C元素的相对分子质量是12,则1mol C的质量为12g/mol | |
| B. | 1mol Cl2的体积为22.4L | |
| C. | 1mol CO2中含有3个原子 | |
| D. | 已知NaOH溶液的物质的量浓度为0.5mol/L,则2L该溶液中含NaOH 1mol |
查看答案和解析>>
科目: 来源: 题型:解答题
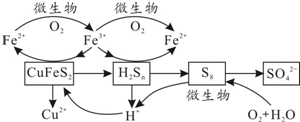
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硅胶疏松多孔,可用作催化剂的载体 | |
| B. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| C. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| D. | 氮的固定只有在高温、高压、催化剂的条件下才能实现 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 | |
| B. | Na2O2既是氧化剂又是还原剂 | |
| C. | Na2FeO4既是氧化产物又是还原产物 | |
| D. | 3mol Na2O2发生反应,有12mol电子转移 |
查看答案和解析>>
科目: 来源: 题型:选择题
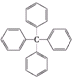 .对该分子的描述正确的是( )
.对该分子的描述正确的是( )| A. | 分子式为C25H20 | B. | 其不是芳香烃 | ||
| C. | 所有碳原子都在同一平面上 | D. | 该物质为脂环烃 |
查看答案和解析>>
科目: 来源: 题型:解答题
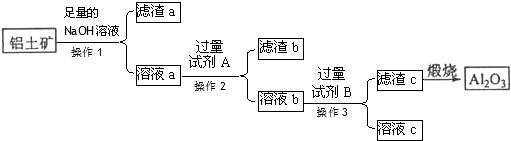
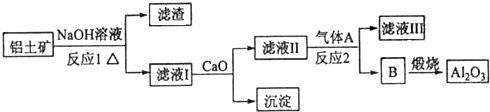
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S2Cl2的结构简式:S-Cl-S-Cl | |
| B. | 13.5g S2Cl2和NaOH反应电子转移数为0.1NA | |
| C. | S2Cl2和NaOH水溶液反应,氧化与还原产物物质的量之比为1:1 | |
| D. | S2Cl2和水反应中,氧化剂还原剂物质的量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com