
科目: 来源: 题型:选择题
| A. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| B. | 分子式是C3H8O的所有同分异构体共3种 | |
| C. | 用乙醇和浓H2SO4制备乙烯时,不可用水浴加热控制反应的温度 | |
| D. | 迷迭香酸结构如图: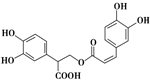 1 mol 迷迭香酸最多能和含6 mol NaOH的水溶液完全反应 1 mol 迷迭香酸最多能和含6 mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu(NO3)2的物质的量为0.01mol | B. | 通入Cl2的体积(标准状况)为448mL | ||
| C. | 放出H2的体积(标准状况)为112mL | D. | 得到不溶固体的质量为6.72g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,1 mol Na2O2中含有的阴、阳离子总数是3NA | |
| B. | 标准状况下,2.24 L苯中含C-H数目为0.6NA | |
| C. | 3.2 g由氧气和臭氧组成的混合物中含有的分子数目为0.1NA | |
| D. | Cl2与NaOH溶液反应每生成1 molNaCl,转移电子的数目为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K2FeO4具有强氧化性,可用作水处理剂 | |
| B. | 氢氧化铝具有弱碱性,可用作制胃酸中和剂 | |
| C. | 碳具有还原性,可用作锌锰干电池的正极材料 | |
| D. | 常温下浓硫酸能使铝发生钝化,可用铝制容器贮运浓硫酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
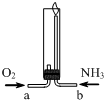
| A. | 气体X的分子式为NO | |
| B. | N2、N4为元素N的两种同素异形体 | |
| C. | 该反应条件下,氨气的还原性小于水 | |
| D. | 两种气体通入的先后顺序是NH3、O2 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题

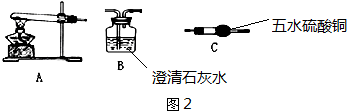

查看答案和解析>>
科目: 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 | |
| 起始量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
| A. | 0~5min内,甲中SO2的反应速率为0.032mol•L-1•min-1 | |
| B. | T℃时,该反应的平衡常数K=400 | |
| C. | 平衡时,甲、丙中气体密度分别为ρ1、ρ2,则ρ2>2ρ1 | |
| D. | 平衡时,SO2的转化率:α1<80%<α2 |
查看答案和解析>>
科目: 来源: 题型:选择题
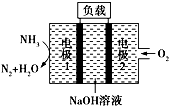
| A. | 电池工作时,电极2上发生氧化反应 | |
| B. | 电池工作一段时间后停止,溶液pH值比开始时明显增大 | |
| C. | 电极1发生的电极反应为2NH3+6OH--6e-═N2↑+6H2O | |
| D. | 用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com