
科目: 来源: 题型:选择题
| A. | 只要是氧化还原反应原理都可以设计成原电池 | |
| B. | Cu+2H+═Cu2++H2↑在任何条件下都不能进行 | |
| C. | 金属的防护可以采取制成合金,改变内部结构的方法 | |
| D. | 现代潜艇的防腐是在潜艇底部贴锌板 |
查看答案和解析>>
科目: 来源: 题型:选择题
| n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
| A | 1.0 | 0 | 1.0 |
| B | 0 | 0 | 2.0 |
| C | 0.2 | 0.1 | 1.8 |
| D | 1.5 | 0.75 | 1.0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:填空题
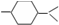 的分子中含有3个手性碳原子;
的分子中含有3个手性碳原子;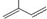 ;
; 所含官能团的名称是碳碳双键、醛基;该有机物发生加成反应后,所得产物的结构简式为CH3CH2CH(CH3)CH2OH.
所含官能团的名称是碳碳双键、醛基;该有机物发生加成反应后,所得产物的结构简式为CH3CH2CH(CH3)CH2OH.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 苯的一溴代物无同分异构体 | |
| B. | 苯的间二溴代物无同分异构体 | |
| C. | 苯的对二溴代物无同分异构体 | |
| D. | 苯不能使溴水或酸性KMnO4溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:实验题
 现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.
现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.查看答案和解析>>
科目: 来源: 题型:实验题
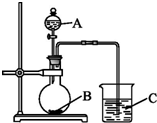
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3X2+Y2═2X3Y | B. | 2X2+Y2═2X2Y | C. | X2+2Y2═2XY2 | D. | X2+3Y2═2XY3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com