
科目: 来源: 题型:选择题
| A. | 1.4mol•L-1 | B. | 1.2mol•L-1 | C. | 1.1mol•L-1 | D. | 1.0mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
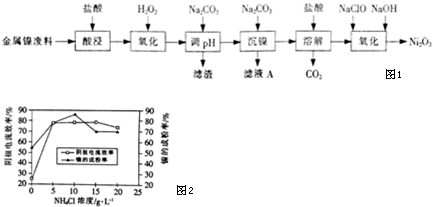
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 按系统命名法,化合物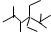 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 可用热的饱和Na2CO3溶液除去金属表面的机油、润滑油 | |
| C. | C4H10的一氯取代物有4种 | |
| D. | 用酸性KMnO4溶液可鉴别2-丁烯和正丁醛 |
查看答案和解析>>
科目: 来源: 题型:实验题
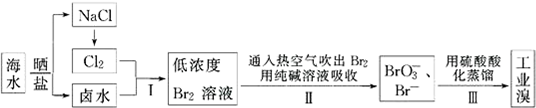
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol固体S单质燃烧放出的热量大于293.23 kJ | |
| B. | 1mol气体S单质燃烧放出的热量小于293.23 kJ | |
| C. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3COO- | B. | SO32- | C. | CO32- | D. | HCO3- |
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:解答题
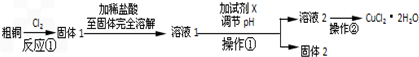
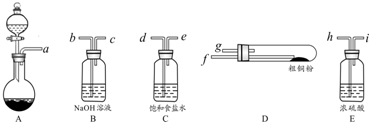
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| C. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 | |
| D. | 常温下,Z单质与W的常见单质直接生成ZW2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com