
科目: 来源: 题型:实验题
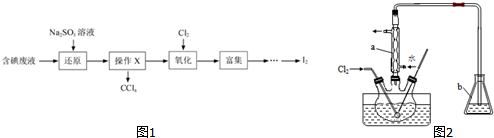
查看答案和解析>>
科目: 来源: 题型:实验题
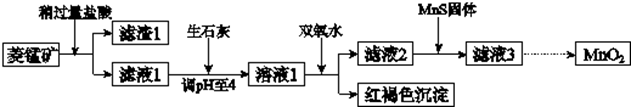
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
| 化学式 | FeS | CuS | MnS |
| 溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 向1mL 0.1mol/L NaOH溶液中加入2mL0.1mol/L CuSO4溶液 ,振荡后滴加0.5mL葡萄糖溶液,加热未出现红色沉淀 | 证明葡萄糖中含有醛基 |
| B | 向1mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生 白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下, Ksp>Ksp |
| C | 测定同温度下相同浓度的碳酸钠和硫酸钠溶液的pH, 前者大于后者 | 证明碳元素非金属性弱于硫 |
| D | 向某溶液中滴加少量稀NaOH溶液,将湿润的红色石蕊试 纸置于试管口试纸不变蓝 | 证明溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 气体 | 试剂 | 现象 | 结论 |  |
| A | X | 酸性KMnO4溶液 | 溶液褪色 | X一定是SO2 | |
| B | NH3 | 酚酞溶液 | 溶液变红色 | 氨水呈碱性 | |
| C | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水有酸性和漂白性 | |
| D | NO2 | 淀粉KI溶液 | 溶液变蓝色 | NO2有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单离子半径:X<Y<W | |
| B. | Y、Z两种元素的氧化物均具有两性 | |
| C. | Z、W形成化合物的电子式为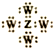 | |
| D. | X、W分别形成的氢化物中所含化学键种类相同 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  除去氯气中的HCl气体 | |
| B. | 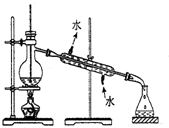 分离Na2CO3溶液和CH3COOC2H5的混合物 | |
| C. | 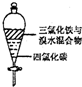 可以萃取,充分振荡后静置,下层溶液为橙红色,上层为无色 | |
| D. | 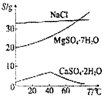 溶解度变化可知,在较低温度下容易分离MgSO4•7H2O和CaSO4•2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| B. | 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 制造新版人民币所用的棉花、优质针叶木等原料的主要成分是纤维素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com