
科目: 来源: 题型:选择题
| A. | 30℃ | B. | 35℃ | C. | 40℃ | D. | 45℃ |
查看答案和解析>>
科目: 来源: 题型:解答题
 HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.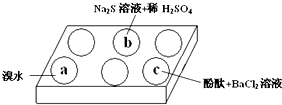
查看答案和解析>>
科目: 来源: 题型:解答题
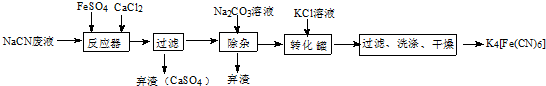
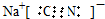 ;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.查看答案和解析>>
科目: 来源: 题型:选择题
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 甲醇 | -97.8℃ | 64.8℃ | 0.791g•mL-1 | 易溶于水、乙醇、正丙醇 |
| 正丙醇 | -126.5℃ | 97.4℃ | 0.804g•mL-1 | 能跟水、甲醇、乙醇以任意比互溶 |
| A. | 萃取 | B. | 过滤 | C. | 蒸发 | D. | 蒸馏 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 小苏打的主要成分是碳酸钠 | |
| B. | NaHCO3的热稳定性小于Na2CO3 | |
| C. | KCl和Na2CO3的固体混合物,加水溶解时有沉淀生成,且沉淀溶于稀盐酸 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀,其离子方程式可以表示为:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子半径A2->C->B2+ | B. | 它们的原子半径C>B>A | ||
| C. | 它们的原子序数A>B>C | D. | 原子最外层上的电子数C>A>B |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 因浓硫酸具有强氧化性,故不可用它来干燥氢气 | |
| B. | 浓硫酸不活泼,可用铁铝容器存放 | |
| C. | 浓硫酸有强氧化性,稀硫酸没有氧化性 | |
| D. | 浓硫酸难挥发,可用来制HF、HCl等挥发性酸 |
查看答案和解析>>
科目: 来源: 题型:实验题
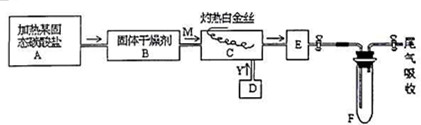
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com