
科目: 来源: 题型:解答题
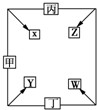 甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如图所示.又如:
甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如图所示.又如:查看答案和解析>>
科目: 来源: 题型:解答题
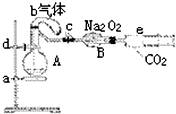 如图所示装置中,a是盛有标况下224mL空气(氧气占五分之一)和10mL 1.2mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器.整套装置经过气密性检查已合格.
如图所示装置中,a是盛有标况下224mL空气(氧气占五分之一)和10mL 1.2mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器.整套装置经过气密性检查已合格.查看答案和解析>>
科目: 来源: 题型:解答题


 ;FHCOOCH=CH2;
;FHCOOCH=CH2;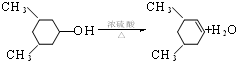 ; 反应④HCOOCH=CH2+H2O$→_{△}^{浓硫酸}$HCOOH+CH3CHO.
; 反应④HCOOCH=CH2+H2O$→_{△}^{浓硫酸}$HCOOH+CH3CHO.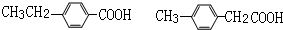 .
.查看答案和解析>>
科目: 来源: 题型:解答题
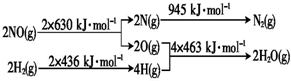
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
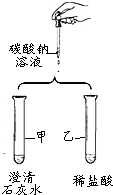 如图是某小组验证碳酸钠性质的实验方案.
如图是某小组验证碳酸钠性质的实验方案.| 实验步骤 | 实验现象 | 结论 |
| 取少量的废液于试管中,滴加2~3滴石蕊试液,振荡. | 无现象 | 废液的pH=7; 猜想Ⅰ成立. |
查看答案和解析>>
科目: 来源: 题型:解答题
| 加入盐酸积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,E是重要的建筑材料,F可用于清除铁锈.它们之间的转化关系如图所示(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).回答下列问题:
A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,E是重要的建筑材料,F可用于清除铁锈.它们之间的转化关系如图所示(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、NO3- | B. | Na+、Ba2+、SO32-、ClO- | ||
| C. | Fe2+、K+、SO42-、NO3- | D. | Na+、Fe3+、S2-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该硫酸试剂可以做干燥剂,干燥任何气体 | |
| B. | 稀释该硫酸时,应将蒸馏水沿玻璃棒缓慢注入其中 | |
| C. | 常温下,2.7g Al与足量的稀硫酸反应得到H23.36L | |
| D. | 配制200mL 4.6mol•L-1的稀硫酸需取该硫酸50.0mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com