
科目: 来源: 题型:选择题
| A. | SiO2、NO2都能与NaOH溶液反应,都是酸性氧化物 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | 为增大氯水中c(HClO),应采取的措施是加入CaCO3固体 | |
| D. | 铁、铝容器常温下可盛放浓硫酸,是因为常温下铁、铝与浓硫酸不反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 78g Na2O2与足量水反应中电子转移了0.2NA | |
| B. | 60g丙醇中存在的共价键总数为10NA | |
| C. | 分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有(不含立体异构)4种 | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | H2通入负极区 | B. | O2通入正极区 | ||
| C. | 负极反应为2H2+4OH--4e-═4H2O | D. | 正极发生氧化反应 |
查看答案和解析>>
科目: 来源: 题型:实验题
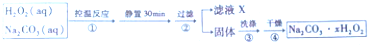

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①②③⑤ | C. | ①②④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 食物放在冰箱中会减慢变质的速率 | |
| B. | 实验室制备CO2时,可通过增加石灰石的用量来加快反应速率 | |
| C. | 工业合成中使用适当的催化剂为了加快反应速率 | |
| D. | 实验室用锌和稀硫酸制取H2时,常滴加少量硫酸铜溶液加快反应的速率 |
查看答案和解析>>
科目: 来源: 题型:解答题
 大型飞机的发动机被誉为航空工业皇冠上的“宝石”.制造过程中通常采用碳化钨做关键部位的材料
大型飞机的发动机被誉为航空工业皇冠上的“宝石”.制造过程中通常采用碳化钨做关键部位的材料查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在反应BrCl+H2O═HCl+HBrO中,BrCl既是氧化剂又是还原剂 | |
| B. | 双氧水与高锰酸钾酸性溶液反应:2KMnO4+3H2O2+3H2SO4═K2SO4+2MnSO4+4O2↑+6H2O | |
| C. | K37ClO3与H35Cl反应的化学方程式为K37ClO3+6H35Cl═K37Cl+335Cl2↑+3H2O | |
| D. | 在反应CH3CH2OH+K2Cr2O7(H+)→CH3COOH中,每消耗1mol乙醇转移4NA个电子(NA为阿伏伽德罗常数的值) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、K+、Ca2+、Cl- | B. | SO42-、Na+、Fe2+、Cl- | ||
| C. | Na+、K+、Cl-、SiO32- | D. | SO42-、NO3-、K+、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com