
科目: 来源: 题型:实验题
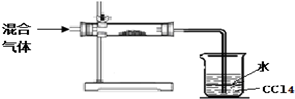
| 实验方案 | 可能的现象和相应的结论 |
| 取少量烧杯中的上层溶液分装入A、B两支试管中 | |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+) | |
| B. | 乙酸溶液中水的电离程度比NaOH溶液中的小 | |
| C. | 若两溶液混合后pH=7,则有:c(Na+)═c(CH3COOH)+c(CH3COO-) | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液中,H+、Fe3+、Br-、NO3-可以大量共存 | |
| B. | 和足量的Ba(OH)2溶液反应的离子方程式:2NH4++Fe2++2SO42-+2Ba2++4OH-═2NH3•H2O+Fe(OH)2↓+2BaSO4↓ | |
| C. | 和KMnO4溶液反应后溶液可以褪为无色 | |
| D. | 该溶液与氢氧化钠溶液共热,产生的气体能使湿润的蓝色石蕊试纸变红 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质 | |
| B. | 分液漏斗在使用前只需检查旋塞芯处是否漏水即可 | |
| C. | 在分液漏斗中加入萃取剂后应上下颠倒摇匀使萃取剂与溶质充分接触 | |
| D. | 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的剧烈程度为L<Q | |
| C. | R最高价氧化物对应水化物是强酸 | |
| D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
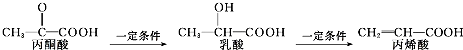
| A. | 三种有机物中都存在2种官能团 | |
| B. | 乳酸和丙烯酸都能使高锰酸钾酸性溶液褪色 | |
| C. | 1mol乳酸最多能与2molNa发生反应 | |
| D. | 三种有机物均能发生加聚反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,在0.10mol•L-1CH3COOH溶液中加入少量CH3COONa晶体,能使CH3COOH的电离度降低,溶液的pH增大 | |
| B. | 常温下向氯化铵溶液中加入少量氨水使溶液中c(NH4+)=c(Cl-),则混合液的pH=7 | |
| C. | pH均为5 的盐酸和硫酸氢钠溶液中,水的电离程度后者大 | |
| D. | pH=3的0.1 mol•L-1HA溶液与0.05 mol•L-1NaOH溶液等体积混合后所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
| 一氯乙酸 | K=1.4×10-3 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com