
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| B. | 某雨水样品放置一段时间后,PH由4.68变为4.00,是因为水中溶解的CO2增多 | |
| C. | 在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化 | |
| D. | 人类对于能源的利用大致可以分为三个时代:柴草能源、化石能源、多能源时代,目前,全球已主要处于多能源时代 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 编号 | Na2SO4溶液 | AgNO3溶液 | 现象 | ||
| 体积/mL | 浓度/(mol•L-1) | 体积 | 浓度/(mol•L-1) | ||
| ① | 1 | 1 | 3滴 | 2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3滴 | 0.5 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3滴 | 0.1 | 有些许浑浊 |
| ④ | 1 | 1 | 3滴 | 0.01 | 无明显变化 |
| 编号 | AgNO3浓度/(mol•L-) | 稀释后Ag+浓度/(mol•L-1) | 混合溶液中SO42-的最小理论检出浓度/(mol•L-1) |
| ① | 2 | 0.2 | 0.0003 |
| ② | 0.5 | 0.0048 | |
| ③ | 0.1 | 0.01 | 0.12 |
| ④ | 0.01 | 0.001 |
| 编号 | AgNO3浓度/(mol•L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 普通玻璃、水泥成分中都含有这三种元素 | |
| B. | 三者的单质在空气中均能稳定存在 | |
| C. | 电解熔融状态的SiO2和Al2O3可以制得Si、Al,且都有氧气生成 | |
| D. | 氧元素与另外两种元素形成的二元化合物都能与NaOH的浓溶液反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯、四氯化碳、无水乙醇、己烯 溴水 | |
| B. | MnO2、FeS、CuO、CuS 稀硫酸 | |
| C. | 甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液 | |
| D. | 苯酚溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
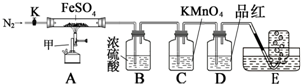 硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.
硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.| 实验 | 滴定管开始读数 | 滴定终点读数 |
| 1 | 0 | 19.98 |
| 2 | 0.10 | 20.12 |
| 3 | 0 | 20.16 |
查看答案和解析>>
科目: 来源: 题型:选择题
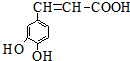
| A. | 与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物的结构有4种(不考虑空间异构) | |
| B. | 咖啡酸只能加聚成高分子化合物 | |
| C. | 咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 1mol该物质与足量的Na2CO3溶液反应,能消耗3 mol CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | ||
| Z | W | ||
| T |
| A. | 根据元素周期律,可以推测存在T3Y4、TZ2和TW4 | |
| B. | W的氧化物的水化物酸性一定比Z的强 | |
| C. | XZ2、XW4与YW3都是非极性分子 | |
| D. | X氢化物的沸点一定比Y氢化物的沸点低 |
查看答案和解析>>
科目: 来源: 题型:选择题
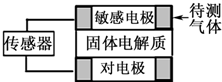 气体自动化检测的探头应用了原电池原理:气体扩散进入敏感电极,发生原电池反应产生电信号,传感器通过对电信号进行分析、判断从而得到结论.如表列出了部分待测气体及敏感电极上部分产物.下列有关说法正确的是( )
气体自动化检测的探头应用了原电池原理:气体扩散进入敏感电极,发生原电池反应产生电信号,传感器通过对电信号进行分析、判断从而得到结论.如表列出了部分待测气体及敏感电极上部分产物.下列有关说法正确的是( ) | 待测气体 | 部分电极反应产物 |
| NO | N2 |
| H2 | H2O |
| CO | CO2 |
| SO2 | SO3 |
| A. | 检测上述气体时,电流均从对电极流向敏感电极 | |
| B. | 检测汽车尾气中的CO时,传感器中通过的电流越大,尾气中CO的含量越高 | |
| C. | 检测SO2时,对电极充入空气,对电极上的电极反应为O2+4H++4e-═2H2O | |
| D. | 检测NO时,敏感电极的电极反应式为:2NO-4e-=N2+2O2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com