
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:阅读理解
| O | 2- 7 |
| 氢氧化物开始沉淀时的pH | 氢氧化物开始沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
| O | 2- 7 |
| O | 2- 7 |
| O | 2- 7 |
| O | 2- 7 |

| O | 2- 7 |
| O | 2- 7 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
 2H2↑+O2↑
2H2↑+O2↑ 2H2↑+O2↑
2H2↑+O2↑
 2HI+H2SO4
2HI+H2SO4 2HI+H2SO4
2HI+H2SO4查看答案和解析>>
科目: 来源: 题型:
| O | 2- 4 |
| O | - 4 |
|
查看答案和解析>>
科目: 来源: 题型:
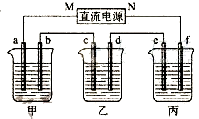 右图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
右图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目: 来源: 题型:
| F | - 2 |
|
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| (2013?天津)为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.反应原理如下: 电池:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O (l) 电解池:2Al+3H2O
电解过程中,以下判断正确的是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com