氯碱工业是高耗能产业,为了提高原料的利用率,将电解的Y气体作为燃料电池的燃料,为电解池供电;X气体作为钛的冶炼原料,在这种工艺设计中,相关物料的传输与转化关系如图所示,其中氯碱工业装置中的电极未标出,所用的离子膜都只允许阳离子通过.如图所示:

(1)①图中的节能型氯碱工业部分,X、Y分别是
Cl2
Cl2
、
H2
H2
(填化学式),分析比较图示中氢氧化钠质量分数8%与6%的大小为
a%<b%
a%<b%
;
②分别写出燃料电池B中正、负极上发生的电极反应,正极:
O2+4e-+2H2O═4OH-
O2+4e-+2H2O═4OH-
,负极:
H2-2e-+2OH-═2H2O
H2-2e-+2OH-═2H2O
;
③这样设计的主要节(电)能之处在于(写出两点):
燃料电池可以为电解池补充电能
燃料电池可以为电解池补充电能
、
提高产品氢氧化钠的浓度,降低能耗
提高产品氢氧化钠的浓度,降低能耗
.
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:
2FeTiO
3+6C+7Cl
22FeCl
3+2TiCl
4+6CO
2FeTiO
3+6C+7Cl
22FeCl
3+2TiCl
4+6CO
.
(3)TiCl
4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H
2TiO
3,写出该反应的化学方程式:
TiCl4+3H2O═H2TiO3+4HCl
TiCl4+3H2O═H2TiO3+4HCl
.
(4)已知:①
Mg(s)+Cl2(g)MgCl2(s)△H=-641kJ?mol
-1②
Ti(s)+Cl2(g)TiCl4(I)△H=-385kJ?mol
-1写出Mg与TiCl
4反应的热化学方程式:
2Mg(s)+TiCl4(s)═2MgCl2(s)+Ti(s)△H-512kJ?mol-1
2Mg(s)+TiCl4(s)═2MgCl2(s)+Ti(s)△H-512kJ?mol-1
,反应在氩气氛围中进行的原因是
Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化
Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化
.




 在如图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C,D为夹在滤纸两端的铂夹,X,Y分别为直流电源的两极.在A,B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入铂电极.切断电源开关S1,闭合开关S2,通直流电一段时间后,请回答下列问题:
在如图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C,D为夹在滤纸两端的铂夹,X,Y分别为直流电源的两极.在A,B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入铂电极.切断电源开关S1,闭合开关S2,通直流电一段时间后,请回答下列问题: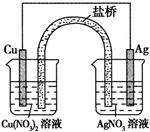 (1)实验证明能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)实验证明能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
 熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO32--52e-═34CO2+10H2O.试回答下列问题:
熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO32--52e-═34CO2+10H2O.试回答下列问题: 二甲醚(CH3OCH3)是一种重要的清洁能源,工业上制二甲醚是在一定的温度(230~290℃)和催化剂条件下进行的,反应中发生了下列一些反应:CO(g)+2H2(g)
二甲醚(CH3OCH3)是一种重要的清洁能源,工业上制二甲醚是在一定的温度(230~290℃)和催化剂条件下进行的,反应中发生了下列一些反应:CO(g)+2H2(g)